Ester - Définition
La liste des auteurs de cet article est disponible ici.
Utilité
Outre le fait d'obtenir un ester, utile dans l'industrie agroalimentaire, en parfumerie ou d'autres secteurs industriels, l'estérification est utile, de par son caractère réversible (pour les acides carboxyliques et les alcools, tout du moins), dans le cadre de la protection de fonctions.
Puisque la transformation est réversible, elle permet de protéger soit la fonction alcool, soit la fonction acide carboxylique, soit les deux. En effet, si l'on imagine par exemple que l'on veut protéger un alcool, on le fait réagir avec un acide carboxylique pour former un ester ; on fait la réaction que l'on voulait effectuer ; une fois celle-ci finie, on renverse la réaction d'estérification pour retrouver l'alcool.
Il existe deux méthodes pour renverser l'estérification :
- utiliser la même réaction (rétro-estérification) en jouant sur les quantités de matière pour que l'équilibre soit favorable à l'acide carboxylique + l'alcool.
- utiliser la réaction de saponification ou hydrolyse en milieu basique des esters.
Les esters sont aussi un constituant de base dans l'industrie des plastiques. Ils sont à la base d'un des plastiques les plus utilisés, le polyester.
Il s'agit d'un moyen de former les lactones : estérification intramoléculaire à partir d'un hydroxyacide carboxylique.
Les esters peuvent être réduits :
- en alcools primaires par l'action du tétrahydruroaluminate de lithium (LiAlH4), dans l'éther diéthylique (éther) ou le THF (tétrahydrofurane)
- en aldéhydes par l'action du DIBAL, dans un solvant non polaire (toluène par exemple), à basse température (-60 °C).
- Quelques esters
- Céride
- Glycéride
- Acétate d'isoamyle
Synthèse
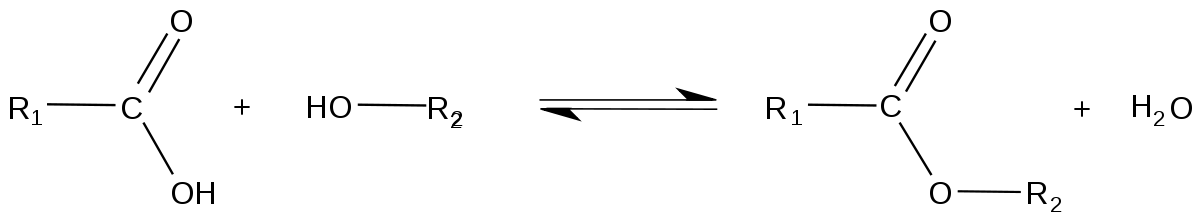
La méthode de synthèse la plus simple et la plus courante est appelée estérification. Il s'agit de la condensation d'un acide carboxylique ou de l'un de ses dérivés (chlorure d'acyle, anhydride d'acide) avec un alcool (chimie), donnant l'ester et un autre composé (eau, acide chlorhydrique ou acide carboxylique).
Dans le cas de la réaction d'un acide carboxylique avec un alcool, on parle de réaction ou estérification de Fischer :
Cette réaction est lente, presque athermique (légèrement exothermique en fait) et réversible (la réaction inverse appelée rétro-estérification est une hydrolyse acide de l'ester), ce qui la rend limitée. Son rendement dépend particulièrement de la classe de l'alcool utilisé (rendement moyen à bon pour des alcools primaires et secondaires, mauvais rendement pour des alcools tertiaires). Il est possible d'améliorer la cinétique de cette réaction (qui sinon met plusieurs mois à atteindre son équilibre) en chauffant (ce qui n'a pas d'influence sur le rendement), ou en la catalysant par un acide. Le rendement quant à lui peut être amélioré par exemple en mettant un réactif en excès ou en distillant l'ester produit pour éviter l'hydrolyse.
Une autre possibilité est d'utiliser des dérivés d'acides pour synthétiser des esters:
- A partir des chlorures d'acyles :
- A partir des anhydrides d'acide :
Ces réactions, contrairement à l'estérification de Fischer présentent l'avantages d'être rapides et totales.
Il est aussi possible de synthétiser un ester à partir d'un autre ester et d'un alcool. On parle alors de transestérification
Cette réaction est utilisée dans l'industrie pour la fabrication du polyester et du biodiesel. Elle est aussi présente en biologie ; c'est entre autres le mécanisme qui permet l'épissage des introns lors de la maturation des ARNm.