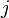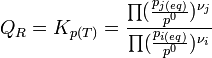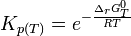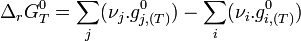Équilibre chimique - Définition
La liste des auteurs de cet article est disponible ici.
Équilibre chimique et constante d'équilibre
Le deuxième principe de la thermodynamique implique que pour une réaction chimique effectuée à T et P constante la fonction
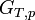
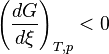
Cette propriété est le critère d'évolution de tout système chimique.
Lorsque la dérivée s'annule, la fonction
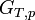
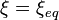
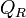
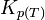
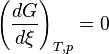
L'équilibre est atteint :
On reconnaît alors l'expression de la constante d'équilibre appelée aussi constante de la loi d'action des masses.
À l'équilibre:
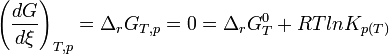
d'où
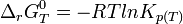
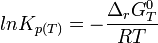
|
|
Dans le cas d'une solution idéale on peut remplacer les activités chimiques par les concentrations et on définit la constante,
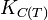
L'enthalpie standard de réaction,
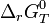
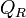
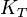
Enthalpie libre standard de réaction
La dérivée de
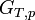
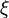
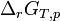
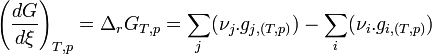
Remplaçons les enthalpies libres molaires par leur expression en fonction de P
- Pour les gaz:
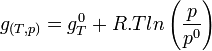
- Pour les solides ou liquides:
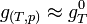
On regroupe les termes standards
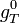
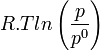
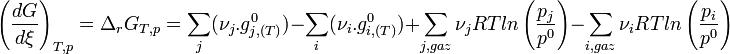
L'expression regroupant les termes standards correspond à l'enthalpie libre standard de réaction à T. C'est une constante qui est accessible à partir des tables thermodynamiques.
|
|
Les termes relatifs aux gaz peuvent être regroupés sous le logarithme; chaque somme devenant un produit.
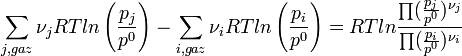
L'expression sous le logarithme regroupant les pressions partielles de chaque gaz est appelée quotient de réaction:
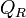
- Ces pressions partielles ne sont pas les pressions de l'équilibre car le système est hors équilibre.
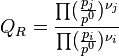
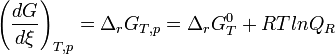
|
Cette relation, établie dans le cas d'un mélange de gaz parfaits formant un système idéal, peut être généralisée aux systèmes contenant des gaz réels ou des solutions. Il suffit de remplacer les pressions partielles par l'activité chimique de chaque constituant.
Déplacement d'un équilibre chimique par ajout d'un réactif ou d'un produit
Considérons un système réactionnel à l'équilibre:
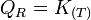
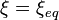
- Si l'on modifie l'activité d'un constituant, le quotient de réaction varie et n'est plus égal à la constante d'équilibre:
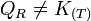
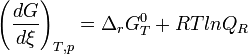
et
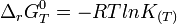
d'où
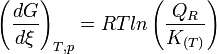
- Supposons que l'on augmente l'activité d'un réactif
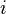
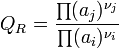
- donc
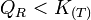
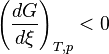
- Si l'on augmente l'activité d'un produit