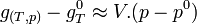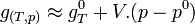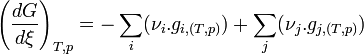Équilibre chimique - Définition
La liste des auteurs de cet article est disponible ici.
Variation de l'enthalpie libre molaire en fonction de P à T constante
Les valeurs d'enthalpies libres molaires de chaque constituant peuvent être calculées à partir de tables thermodynamiques ( en réalité elles ne sont pas connues de façon absolue; une échelle arbitraire d'enthalpie libre ayant été définie: voir enthalpie standard de formation) mais ces valeurs correspondent à la pression standard P° = 1 bar. Il faut donc connaître la variation de
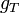
Pour un corps pur la différentielle de G est égale à :
-
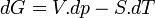
A température constante, la différentielle de l'enthalpie libre molaire est:
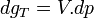
Intégrons entre P° et P
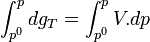
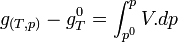
Trois cas principaux peuvent se présenter :
- Le système ne comprend que des phases condensées (solides ou liquides) séparées. Le milieu est hétérogène.
- Le système comprend un mélange de gaz (considérés comme parfait: système idéal).
- Le système est une solution contenant des espèces moléculaires ou ioniques.
Les phases condensées sont peu compressibles. Si la variation de pression n'est pas trop importante ( quelques dizaines de bar), le volume molaire variera peu et on peut dans ce cas considérer que V est pratiquement constant.
Il est même possible de considérer, avec une bonne approximation que
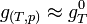
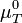
Dans le cas d'un système composé d'un mélange de gaz parfaits, l'évolution en fonction de P ne peut plus être négligée car les gaz sont compressibles. Si on applique l'équation d'état du gaz parfait:
-
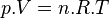
-
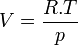
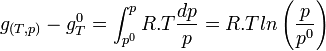
d'où
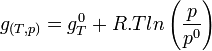
|
Enthalpie libre de réaction
La fonction enthalpie libre, G permet de définir le sens d'une réaction chimique effectuée à T et P constante. Si la réaction est équilibrée, le minimum de G permet de définir l'équilibre et la composition du système réactionnel. Il faut donc calculer G pour un avancement donné
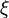
- Soient
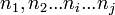
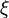
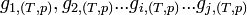
- L'enthalpie libre molaire est une grandeur molaire partielle définie par la relation :
-
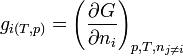
- Il s'ensuit:
-
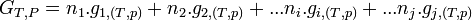
- Pour une variation élémentaire
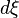
-
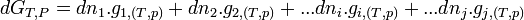
- or
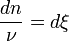
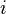
- Donc,
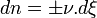
- d'où
-
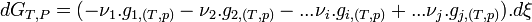
- Regroupons les termes correspondant aux réactifs
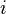
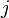
-
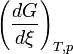
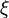
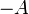
- L'expression
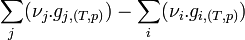
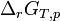
- Remarques: On exprime souvent l'enthalpie libre de réaction sans différencier les réactifs
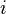
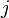
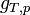
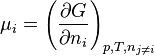
- ce qui donne:
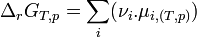
Pour résumer
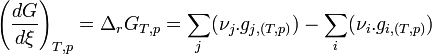
|