Effet inductif - Définition
La liste des auteurs de cet article est disponible ici.
Moment dipolaire électrique
Lorsque deux atomes A et B sont liés et partiellement chargés électriquement, on constate qu'il existe un moment dipolaire, noté

Le moment dipolaire d'un composé est la somme vectorielle des moments dipolaires qui existent entre chaque liaison. C'est la valeur de ce moment dipolaire qui est mesuré expérimentalement, il est très difficile de calculer la valeur du moment dipolaire d'un composé (ce calcul prend en compte le barycentre des charges partielles de chaque atome, difficilement calculables et positionnables dans l'espace), l'unité de mesure usuelle est le Debye.
Effet inductif en chimie organique
Particularités
Les composés organiques sont principalement formés de carbone et d'hydrogène. En chimie organique, les éléments autres que le carbone et l'hydrogène sont des hétéroatomes ; les atomes (ou groupes d'atomes) différents de l'hydrogène liés à un carbone sont appelés substituants.
On parlera donc particulièrement d'effet inductif attracteur, ou donneur, d'un substituant par rapport au carbone.
Notation : dans les formules chimiques les substituants notés R sont soit des groupements alkyles, soit des hydrogène.
Substituants à effet attracteur (-I)
Les substituants à effet inductif attracteur, noté -I, sont des substituants qui ont une électronégativité plus élevée que celle du carbone. Une grande partie des hétéroatomes rencontrés en chimie organique ont un effet inductif attracteur. Ci-dessous une liste non exhaustive des principaux substituants à effet -I rencontrés en chimie organique :
- substituants halogénés :
- subsituants azotés :
- -NH2, le groupement et la fonction amine ;
- -NO2, le groupement nitro ;
- substituants possédant un oxygène :
- -OH, le groupement hydroxyle et la fonction alcool ;
- substituants carbonnés (alcyles ou allyles) :
- phényle ;
- CH=CH2, le groupement vinyle ;
- et plus généralement tout groupement insaturé.
Substituants à effet donneur (+I)
Les substituants à effet inductif donneur, noté +I, sont des substituants qui ont une électronégativité inférieure à celle du carbone, et de l'hydrogène. Relativement peu d'hétéroatomes (les alcalins et les alcalino-terreux) ont un effet inductif donneur. Ci-dessous une liste non exhaustive des principaux substituants à effet +I rencontrés en chimie organique :
- les alcalins ou alcalino-terreux:
- les boranes
- -BRR'
- et les groupements alkyles
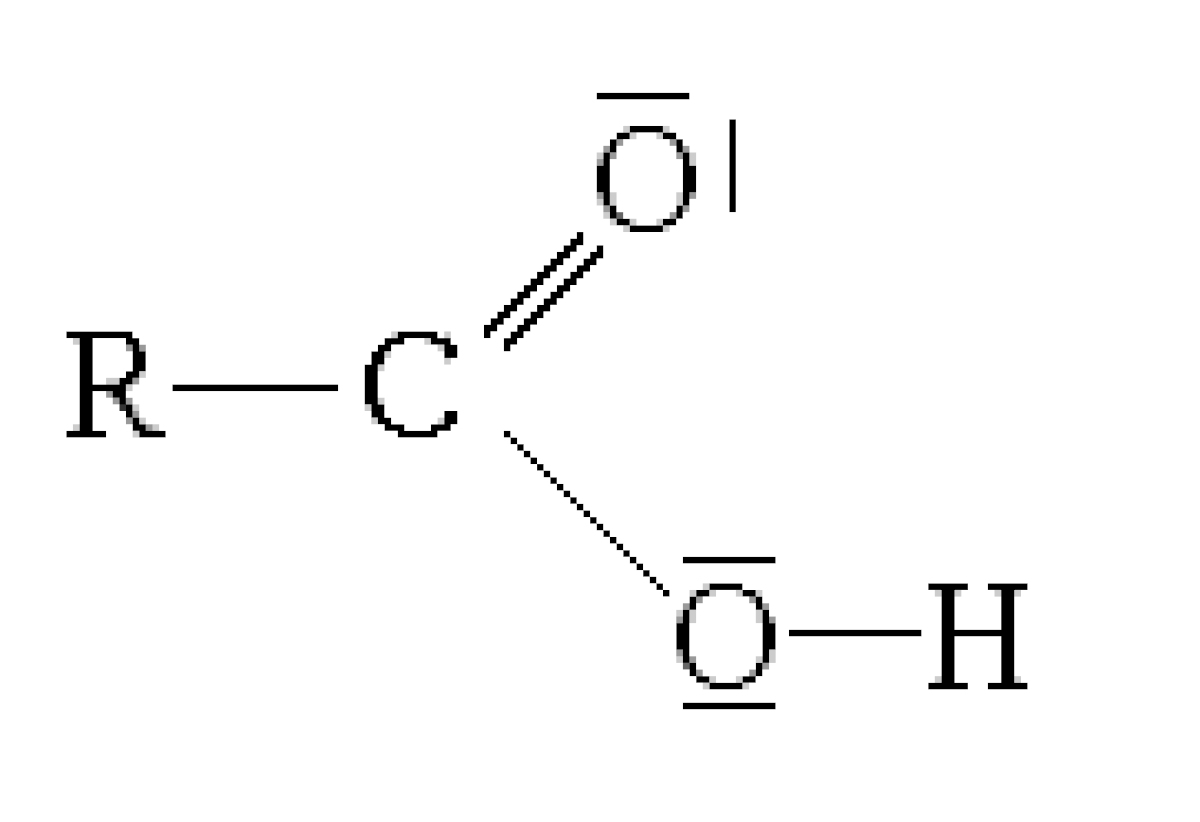
Acidité des acides carboxyliques
Les acides sont caractérisés selon leur force par une constante d'acidité, le pKa. Plus le pKa est faible, plus l'acide est fort.
Les acides carboxyliques sont des composés organiques du type R-COOH.
RCOOH + H2O ⇔ RCOO- + H3O+
Si R est un groupement attracteur (-I) la polarité de la liaison O-H est plus importante, l'hydrogène est donc moins attaché à l'oxygène et est plus facilement détachable. L'acide est alors plus fort, et le pKa plus faible. Le raisonnement est aussi applicable à la forme basique. L'effet inductif compense légèrement la charge négative de RCOO- qui est alors plus stable, donc plus présent en solution aqueuse, l'équilibre de dissociation de l'acide est déplacé vers la droite : l'acide est plus fort.
À l'inverse, si R est un groupement donneur (+I), la liaison O-H est moins polarisée et l'hydrogène plus difficile à arracher. L'acide est alors plus faible, et le pKa plus élevé.
Stabilité des carbocations
Les carbocations sont des intermédiaires de réaction, chargés positivement au niveau d'un carbone. La stabilité des carbocations définit quel produit de réaction sera obtenu en majorité, c'est donc un facteur important dont il faut tenir compte pour de nombreuses réactions organiques. Les carbocations sont donc stabilisés par effet inductif donneur, donc généralement par la présence de groupements alkyles. Un carbocation tertiaire (le carbone chargé est lié à trois autres carbones) sera plus stable qu'un secondaire, lui-même plus stable qu'un primaire.