Duloxétine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| duloxétine | |
|---|---|
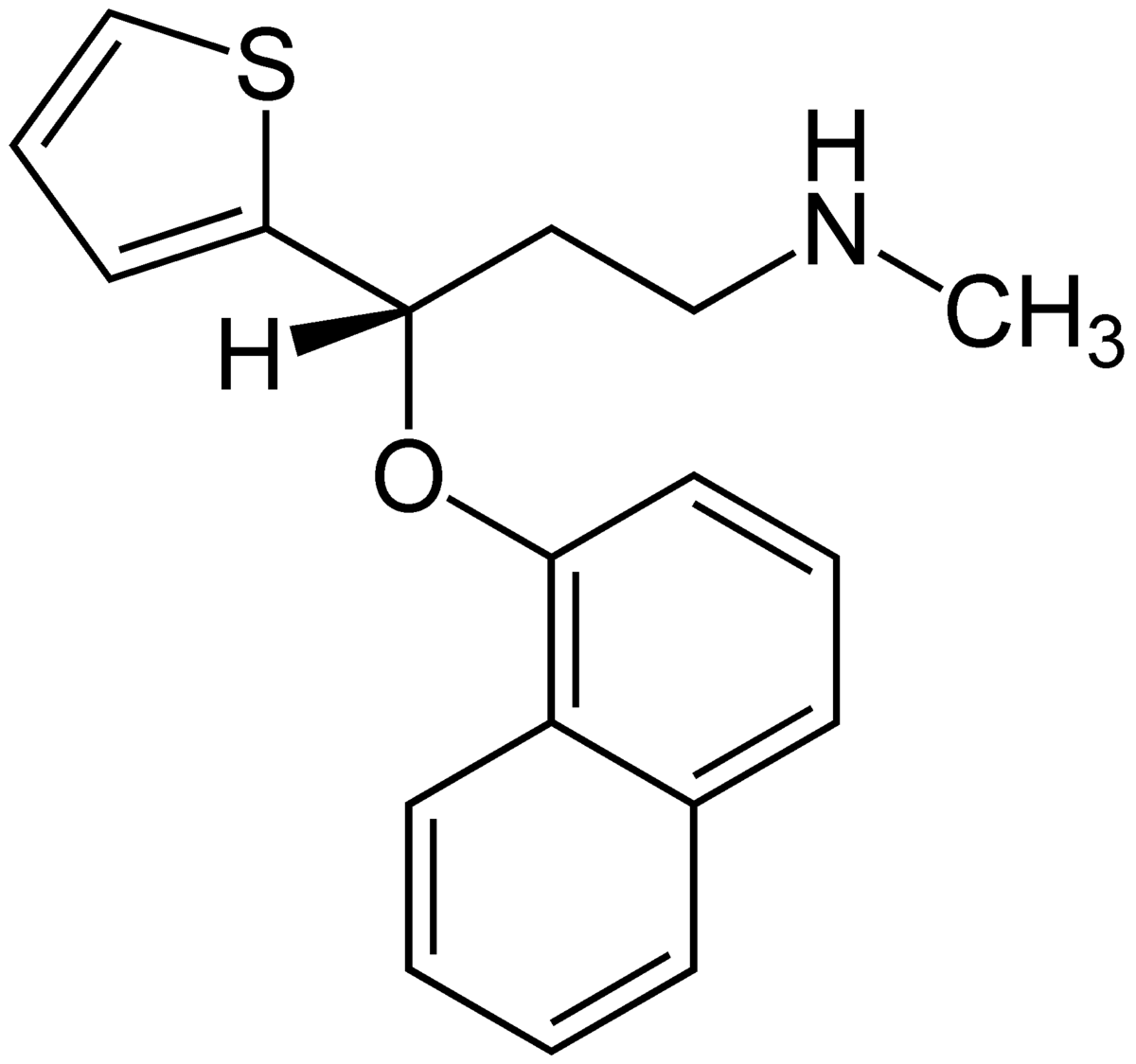 | |
| Général | |
| Nom IUPAC | |
| No CAS | (racémique) S(+) R(–) |
| Code ATC | N06 |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C18H19NOS |
| Masse molaire | 297,415 ± 0,021 g·mol-1 |
| Classe thérapeutique | |
| Antidépresseur IRSNA | |
| Données pharmacocinétiques | |
| Biodisponibilité | ~ 50% (32% à 80%) |
| Métabolisme | Hépatique (CYP2D6) et (CYP1A2) |
| Demi-vie d’élim. | 12 heures |
| Excrétion | 70% urines, 20% selles |
| Considérations thérapeutiques | |
| Voie d’administration | Orale |
| | |
La duloxétine, commercialisée dans divers pays sous les noms de Cymbalta®, Yentreve®, Xeristar® ou AriClaim® est un antidépresseur inhibiteur de la recapture de la sérotonine-noradrénaline. Il est utilisé pour le traitement de l'épisode dépressif majeur, du trouble de l'anxiété généralisée, de la douleur liée à la neuropathie diabètique, de la Fibromyalgie et de l'incontinence urinaire d'effort.
La duloxétine a été découverte et brevetée par le laboratoire Eli Lilly.
Histoire
La duloxétine a été créée par les chercheurs David Robertson, David Wong (également codécouvreur de la fluoxétine et Joseph Krushinski; du laboratoire Eli Lilly. La demande de brevet a été déposée en 1986 et le brevet accordé en 1990. La première publication sur la découverte de l'un des deux énantiomères de la duloxétine connu sous le nom de LY227942, a été faite en 1988., mais c'est le second énantiomère (+) LY248686 qui sera choisi pour la suite des études car il inhibait deux fois plus la recapture de sérotonine que l'énantiomère (-).
Après de nombreux test, en 2001, Eli Lilly présente la duloxétine à la FDA pour le traitement de la dépression, celle-ci ne l'acceptera qu'en 2004 après que Eli Lilly eut résolu des problèmes d'hépatoxicité et d'augmentation de la pression artérielle.
La FDA approuve donc la duloxétine dans le traitement de l'épisode dépressif majeur et de la neuropathie diabétique.
En 2007, c'est au tour de Santé Canada d'approuver la duloxétine dans le traitement de l'épisode dépressif majeur et de la neuropathie diabétique.
Dans l'Union européenne, la commission a accordé la mise sur le marché de la duloxétine pour l'incontinence urinaire d'effort et de l'épisode dépressif majeur respectivement en août et décembre 2004 et en février 2005 pour le traitement des douleurs périphériques liées à la neuropathie diabétique, ce contrairement aux États-Unis où la FDA refusa cette indication et Lilly abandonna cette demande sur le marché américain un ans plus tard.
Le 16 juin 2008, la FDA accorde une autorisation à la duloxétine pour le traitement de la fibromyalgie. La commission d'AMM européenne donne en octobre 2008 un avis défavorable à cette indication parce que l'efficacité de ce psychotrope n'était pas solidement démontrée. Quatre essais, indépendants du Laboratoire Lilly, n'auraient pas permis d'améliorer l'état des patients souffrant de fibromyalgie.
