Dioxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Caractéristiques physico-chimiques
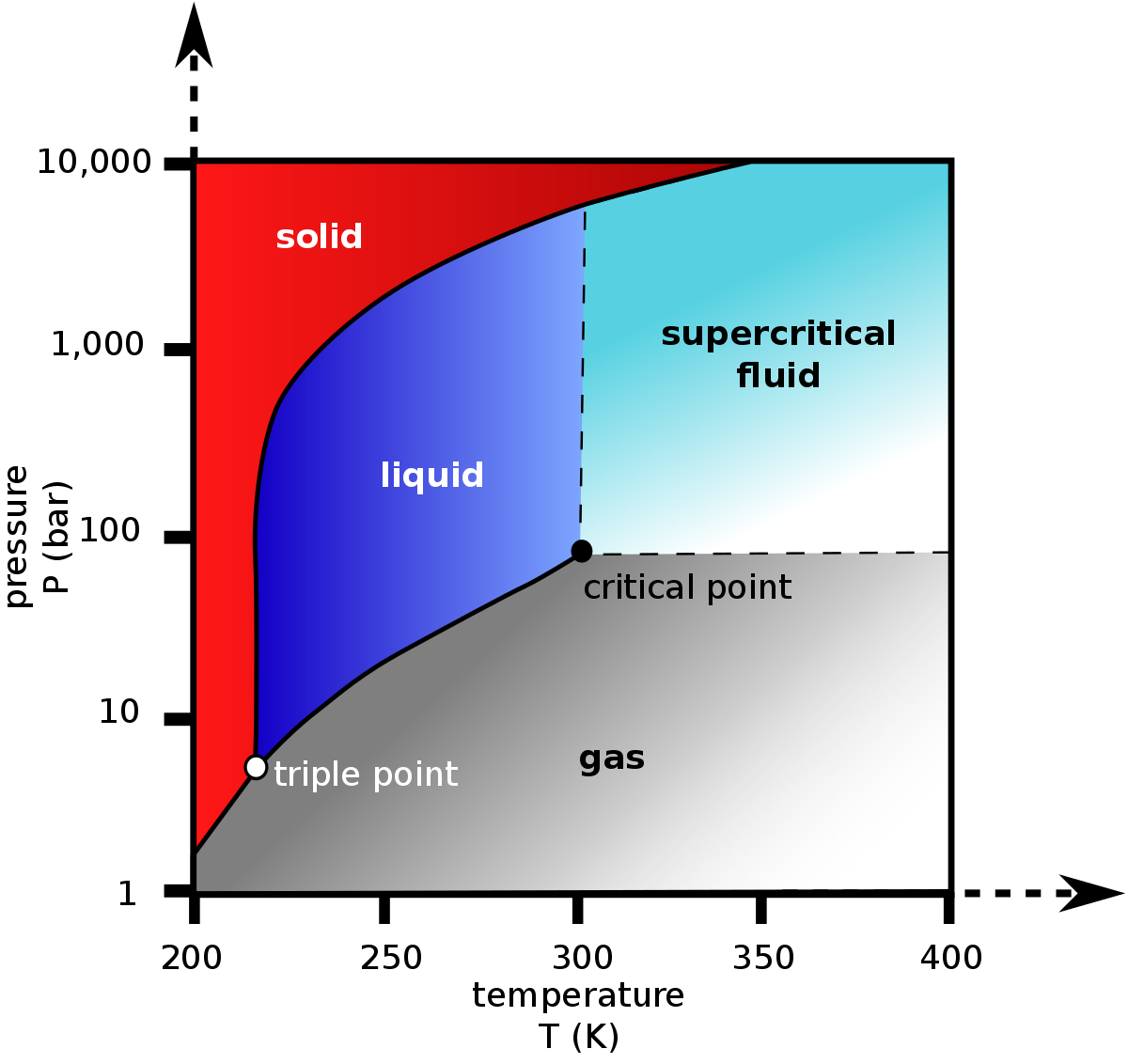
À pression atmosphérique, il se sublime à -78,5 °C (passage de l'état solide à l'état gazeux), mais ne fond pas (passage de l'état solide à l'état liquide).
La phase liquide ne peut exister qu'à une pression minimale de 5,19 hPa=5,11 atm, et dans un intervalle de température allant de -56,6 °C (point triple) à 31,1 °C au maximum à 74 hPa=72 9 atm (point critique).
|
|

| Transition | Température | Chaleur latente |
|---|---|---|
| Vaporisation | 0 °C | 234,5 kJ.kg−1 |
| Vaporisation | -16,7 °C | 276,8 kJ.kg−1 |
| Vaporisation | -28,9 °C | 301,7 kJ.kg−1 |
| Fusion | -56,6 °C | 199 kJ.kg−1 |
Solubilité aqueuse
Le CO2 se dissout dans l’eau et forme avec elle de l’acide carbonique (H2CO3). Il est aussi liposoluble.
L’acide carbonique n’est que modérément stable et il se décompose facilement en H2O et CO2. En revanche, lorsque le dioxyde de carbone se dissout dans une solution aqueuse basique (soude, potasse...), la base déprotone l’acide carbonique pour former un ion hydrogénocarbonate (HCO3–), aussi appelé ion bicarbonate, puis un ion carbonate (CO32–). De cette façon, la solubilité du CO2 est considérablement augmentée.
Par exemple, une solution aqueuse saturée de carbonate de potassium (K2CO3) a une concentration de 112 % (en masse) en carbonate à 20 °C.
C'est ainsi que le calcaire se dissout dans l'eau, dans la plage de pH dans laquelle l'hydrogénocarbonate acide est stable, en produisant une solution d'hydrogénocarbonate(s) (de calcium et de magnésium...). Il est donc susceptible de précipiter lorsque le CO2 dissous est dégazé, comme dans la formation des stalagmites et des stalactites. Ainsi, en présence de CO2, le calcaire a une solubilité suivant celle des gaz (qui diminue avec la température) et non de celle des solides (qui augmente avec la température).