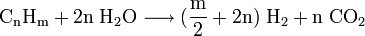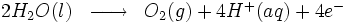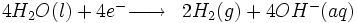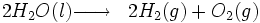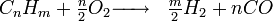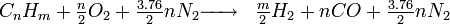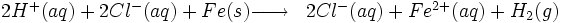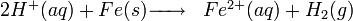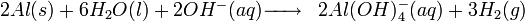Dihydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Histoire
Le premier scientifique connu à avoir décrit la production de dihydrogène est le suisse Paracelse (1493-1541). Il fait cette découverte en versant du vitriol sur de la poudre de fer, mais ne comprend pas la nature exacte du gaz dégagé au cours de l'expérience.
Le chimiste anglais Henry Cavendish (1731-1810), recommençant les expériences de Paracelse avec plusieurs métaux différents, découvre que le gaz ainsi produit est différent de l'air, est inflammable et a une faible densité. Il appelle ce gaz « air inflammable » (en anglais : inflammable air) et s'aperçoit que sa combustion produit de l'eau. Le dioxygène étant lui nommé « air vital ».
Le chimiste français Antoine Lavoisier ayant confirmé les expériences de Cavendish, propose le mot « hydrogène » pour remplacer l'expression « air inflammable ». Ce mot est formé avec le préfixe hydro (du grec ὕδωρ (hudôr), « eau ») et du suffixe gène (du grec γεννᾰν (gennen), « engendrer »).
Par la suite, dans le domaine scientifique, le mot « hydrogène » sera utilisé pour nommer l'élément chimique H et le mot « dihydrogène » sera utilisé pour la molécule H2.
Réactions de base de la production de dihydrogène
Au XIXe siècle, pour produire de l’hydrogène, on chauffait de l’eau, on envoyait ensuite la vapeur d’eau obtenue dans un tonneau rempli de limailles et copeaux de fer. La vapeur d’eau H2O attaquait le métal créant de l’oxyde de fer et libérant du dihydrogène. Le dihydrogène, sortait ensuite du tonneau, on le filtrait dans un autre tonneau rempli d’eau. Puis, direct au ballon. Ce dispositif permettait à l’armée de gonfler n’importe où et en quelques heures un ballon d’observation.
L'hydrogène est produit industriellement par deux procédés :
- par vaporeformage à partir d'hydrocarbures (en particulier à partir de méthane)
- par électrolyse de l'eau
D'autres procédés sont aussi à l'étude, basés sur le craquage ou l'oxydation partielle, qui a l'avantage d'être exothermique
Vaporeformage d'hydrocarbures
Le vaporeformage d'hydrocarbures est le procédé qui, au XXIe siècle, est le plus utilisé au niveau industriel. Son principe est basé sur la dissociation de molécules carbonées (méthane...) en présence de vapeur d'eau et de chaleur. La réaction globale s'écrit:
Le rendement énergétique est de l'ordre de 40 à 45% dans certaines installations. En pratique industrielle, il est nécessaire d'aider la réaction à l'aide de catalyseurs ou de brûleurs. Elle a l'inconvénient de produire du dioxyde de carbone, un gaz à effet de serre.
Électrolyse de l'eau
Cette technologie consiste à faire passer un courant électrique dans l'eau afin d'obtenir la dissociation des molécules d'eau en dihydrogène et dioxygène.
Réaction à l'anode :
Réaction à la cathode :
Globalement, nous avons :
Cette technologie nécessite de grandes quantités d'électricité. Elle est aussi cependant aujourd'hui efficace d'un point de vue énergétique : l'énergie potentielle du dihydrogène produit correspond à environ 80% de l'énergie électrique consommée. Elle est relativement peu utilisée.
Oxydation partielle d'hydrocarbures
Cette réaction est une combustion "riche" dans le sens où l'on vise la production d'un gaz riche en H2 et CO (gaz de synthèse); au lieu des produits "classiques" CO2 et H2O.
La réaction s'écrit:
La plupart du temps, on utilise l'air comme comburant. Nous avons alors:
La réaction est exothermique: par exemple, l'enthalpie de la réaction avec le méthane est de -35.7 kJ/mol.
Tout comme la réaction de vaporeformage, il est nécessaire de catalyser la réaction.
L'intérêt de la réaction d'oxydation partielle réside dans son caractère exothermique (contrairement à la réaction de vaporeformage) qui permet d'aider la catalyse (élévation de température).
L'inconvénient majeur réside dans le fait que les pourcentages de H2 sont inférieurs à ceux obtenus par vaporeformage, à cause de la présence majoritaire de l'azote de l'air. De plus, il est possible d'obenir des NOx.
Action de l'acide chlorhydrique sur le fer
Au laboratoire de Chimie (collège ou lycée), on produit parfois du dihydrogène par action de l'acide chlorhydrique sur du fer.
ou, formule simplifiée :
Action de l'hydroxyde de sodium sur l'aluminium
On peut également produire du dihydrogène par la réaction d'hydroxyde de sodium avec de l'aluminium.
Hydrogène renouvelable
Afin d'être une énergie vraiment avantageuse en termes d'environnement, l'hydrogène doit notamment pouvoir être produit à partir d'énergie renouvelable.
Il est possible de réaliser l'électrolyse de l'eau à partir d'électricité renouvelable mais le rendement faible de cette étape diminue la quantité d'énergie globale disponible.
Une autre voie de production d'hydrogène renouvelable se fait par fermentation de biomasse: on peut alors parler de biohydrogène. Certains travaux de recherche se font sur la fermentation directe d'hydrogène à partir de substrats et micro organismes spécifiques. Une autre voie est la fermentation anaérobie, voie de dégradation de matière organique (déchets notamment) très courante, la production de biogaz et le reformage du méthane contenu dans le biogaz, en hydrogène comme présenté plus haut dans la partie vaporeformage.