Diamant - Définition
La liste des auteurs de cet article est disponible ici.
Propriétés
Le diamant est une forme métastable du carbone dans les conditions de température et de pression normales. Il brûle dès 500 °C dans un courant d'air, mais s'il est maintenu à 1 100 °C sous atmosphère neutre, il se transforme en graphite.
Structure cristalline
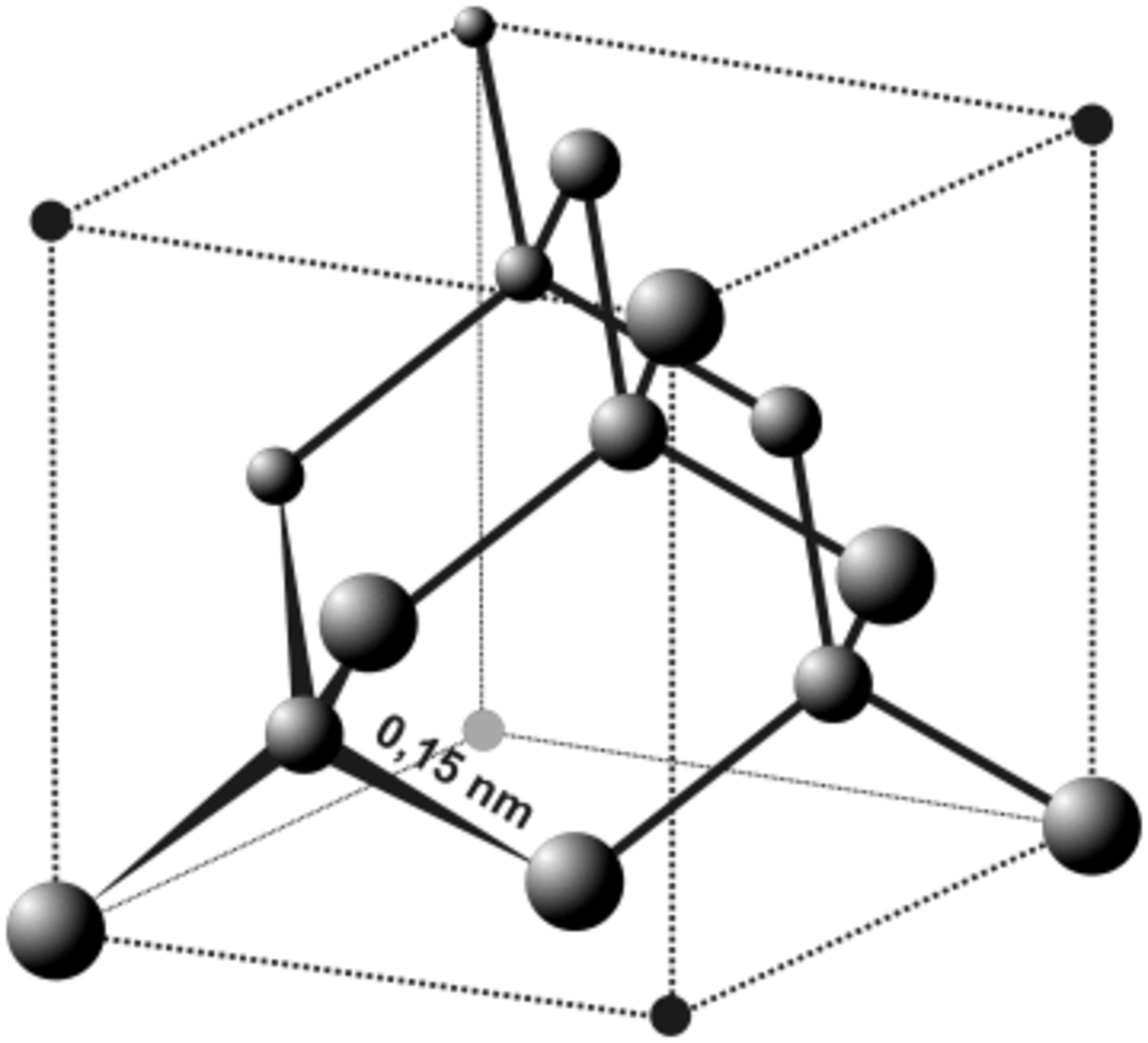
Dans son état naturel, le diamant possède une structure dérivée de la structure cubique à faces centrées, appelée structure type diamant où en plus des atomes au coins du cube et au centre de chaque face, quatre des huit sites tétraédrique sont occupés, ce qui donne finalement huit atomes par maille élémentaire (contre 4 pour une structure cfc classique), et fait que chaque atome de carbone a quatre voisins.
Cette structure est notée A4 en notation Strukturbericht. Son groupe d'espace est
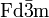
- a = 3,566 7 Å
Le volume d'une maille est de 45,37 Å3, la densité théorique est de 3,517.
Propriétés physiques
Sa masse molaire est de 12,02 g·mol-1, sa masse volumique mesurée est de 3 520 kg/m3.
Dans l'édifice cristallin du diamant, les liaisons entre atomes de carbones résultent de la mise en commun des électrons de la couche périphérique afin de former des couches saturées. Chaque atome de carbone est ainsi associé de façon tétraédrique à ses quatre voisins les plus proches (hybridation sp3 du carbone), et complète ainsi sa couche extérieure. Ces liaisons covalentes, fortes et donc difficiles à casser, couvrent tout le cristal, d'où sa très grande dureté.
La forme liquide du diamant aurait la particularité comme l'eau d'être plus dense que la forme solide d'après un article paru dans la revue Nature Physics. Les conditions pour la phase liquide pourraient être réunis sur Uranus et Neptune.
La conductivité électrique est basse, car les électrons ne se regroupent pas comme dans un métal : ils restent liés aux atomes et ne peuvent pas, par exemple sous l'action d'un champ électrique extérieur, former un nuage électronique qui transporterait le courant de façon continue. En d'autres termes, le diamant est un très bon isolant. Néanmoins, il fait l'objet d'études en tant que semi-conducteur à large bande pour l'électronique de puissance.
La conductivité thermique du diamant est exceptionnelle, ce qui explique pourquoi il paraît si froid au toucher. Ce minéral est, de loin, le meilleur conducteur connu de la chaleur. Dans un cristal isolant électrique comme le diamant, la conductivité thermique est assurée par les vibrations cohérentes des atomes de la structure. Des valeurs de 2 500 W/(m·K) ont été mesurées, que l'on peut comparer aux 401 W/(m·K) du cuivre et aux 429 W/(m·K) de l'argent. Cette propriété en fait un candidat comme substrat pour le refroidissement des semi-conducteurs.
Enfin, le coefficient de dilatation du diamant, lié aux propriétés des vibrations de la structure de ce matériau, est très faible. Pour le diamant pur, l'accroissement relatif de longueur par degré est d'environ un millionième à température ambiante, que l'on peut comparer aux 1,2 millionièmes de l'Invar, alliage constitué de 64 % de fer et de 36 % de nickel, qui est réputé pour sa très faible dilatation. Le fer est très loin derrière, avec 11,7 millionièmes.
Propriétés optiques
Le diamant est transparent, translucide ou opaque ; son indice de réfraction est particulièrement élevé, et varie en fonction de la longueur d'onde : ce sont ces propriétés qui lui donnent son éclat caractéristique, « adamantin ». Cet indice est de 2,407 pour la lumière rouge (687 nm), 2,417 pour la lumière jaune (589 nm), 2,426 pour la lumière verte (527 nm) et 2,451 pour la lumière violette (431 nm).