Diagramme de phase - Définition
La liste des auteurs de cet article est disponible ici.
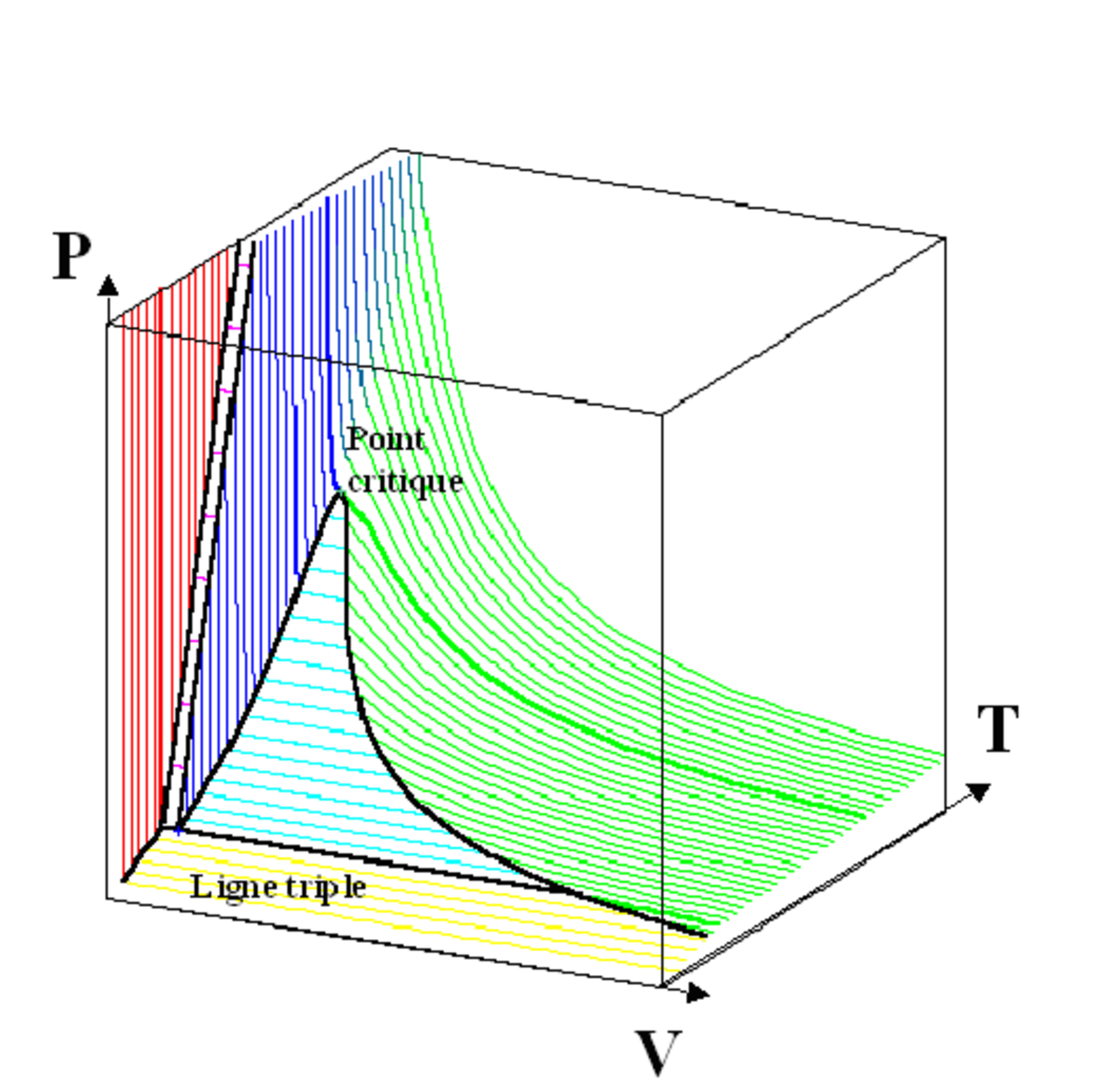
Diagramme (P, V, T)
Dans le cas des changements d'état (gaz-liquide-solide) d'un corps pur, les résultats sont parfois présentés sous la forme d'un diagramme en trois dimensions, les axes étant la pression P, le volume V occupé par le système et la température T.
Ce diagramme tridimensionnel est construit à partir de trois types de diagrammes utilisés en thermodynamique : les diagrammes de changement d'état, les diagrammes isothermes de Clapeyron et les diagrammes isobares.
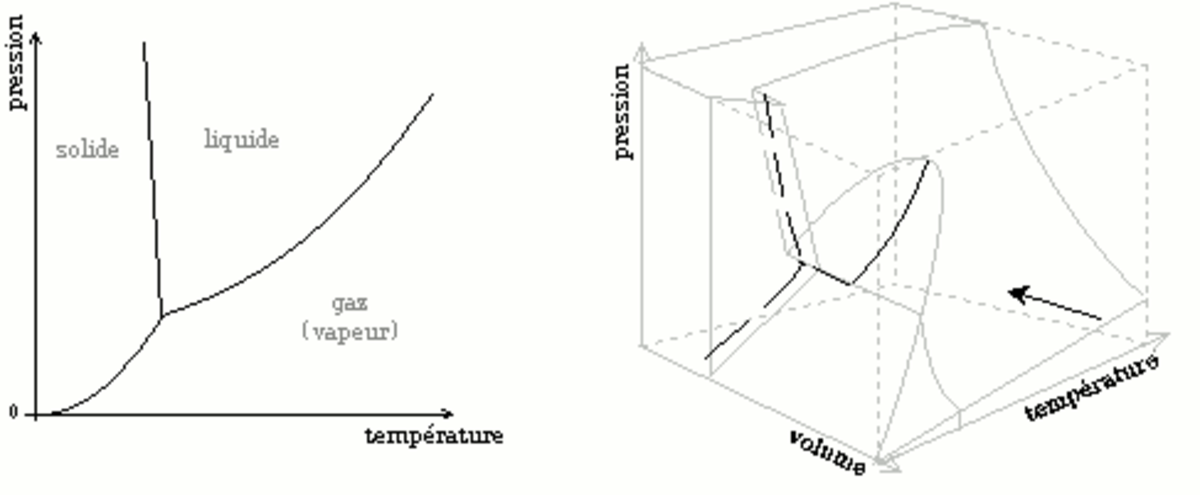
La figure ci-dessous montre un diagramme thermodynamique comme une « coupe » ou une « projection » du diagramme (P, V, T). La flèche indique la direction de projection.
Comment établit-on un diagramme de phases ?
Le diagramme de phase s'établit expérimentalement : on fait varier les conditions et l'on observe les changements de phase.
Les changements de phase peuvent s'observer de plusieurs manières :
- certains produisent de la chaleur (par exemple la condensation ou une réaction chimique exothermique) ou en absorbent (par exemple la fusion ou des réactions chimiques endothermiques), donc en mesurant les flux de chaleur, on sait si un changement de phase a lieu ; c'est l'analyse thermodifférentielle (ATD) ;
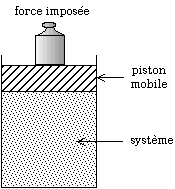
- certains induisent un changement de volume, une contraction (comme la condensation ou le réarrangement des atomes d'un solide dans une configuration plus compacte) ou une expansion (comme la vaporisation ou le réarrangement des atomes d'un solide dans une configuration moins compacte), il suffit alors de mesurer les changements de volume, par exemple avec un piston mobile, la force étant imposée par le poids d'une masse ou bien par un système hydraulique ;
- on peut à l'inverse observer les variations de pression, avec un manomètre, en imposant le volume avec un piston mobile actionné par une vis sans fin ;
- observer à l'œil nu l'état du système (par exemple la fusion des cristaux) ;
- pour les différentes phases solides, on peut reconnaître les différentes phases cristallines par diffraction de rayons X ; on peut faire l'analyse sur l'échantillon chaud, ou bien tremper l'échantillon, c'est-à-dire lui faire subir un refroidissement rapide afin qu'il conserve sa structure d'équilibre à chaud même lorsqu'il est froid (il n'est donc pas à l'équilibre).
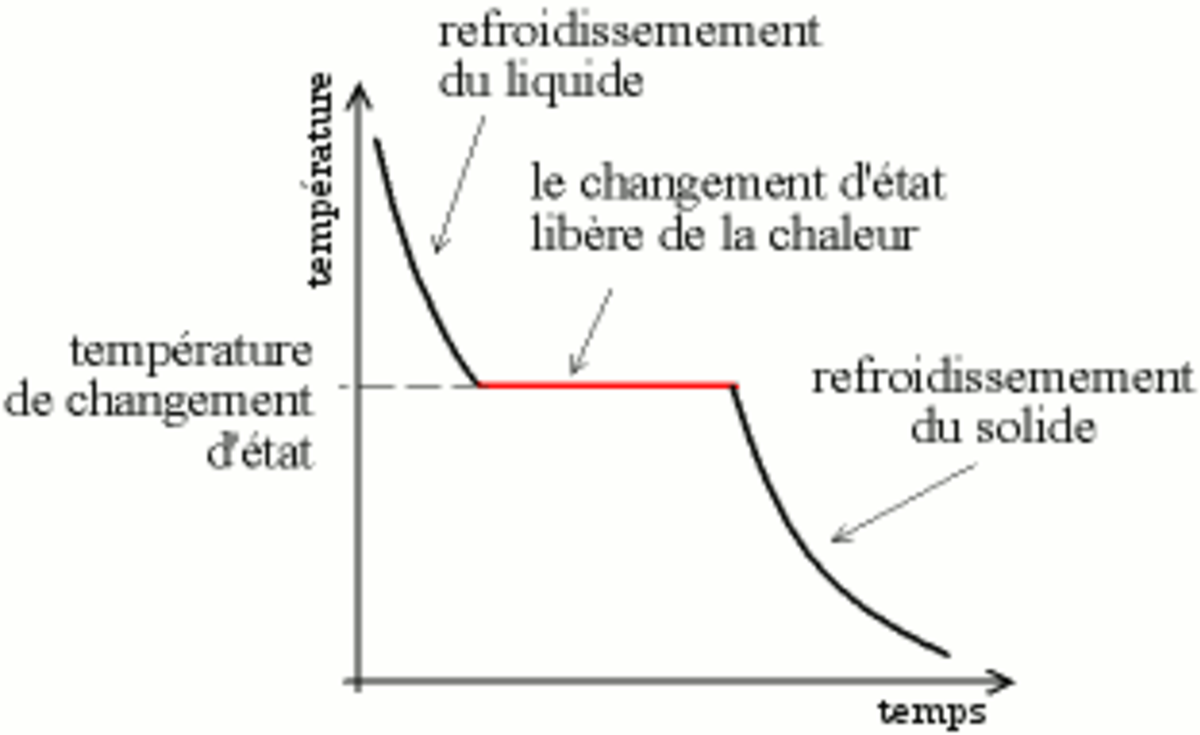
La courbe de solidification, utilisée pour déterminer la température de changement d'état, est de l'analyse thermodifférentielle simplifiée ; elle consiste à laisser refroidir un liquide et à mesurer sa température. La vitesse de perte de chaleur est proportionnelle à la différence de température entre le système et l'extérieur, on a donc une courbe exponentielle. Lorsque l'on observe un plateau, cela signifie que l'échantillon libère de la chaleur, ce qui est caractéristique de la solidification. Lors d'un changement de phase (changement de structure cristalline) dans le solide on peut observer un plateau de la même manière.