Diagramme de phase - Définition
La liste des auteurs de cet article est disponible ici.
Diagramme binaire et ternaire
Lorsque l'on a un système composé de deux corps purs, le système peut être sous plusieurs formes :
- entièrement solide, chaque corps cristallisant séparément ;
- entièrement solide, les deux corps étant parfaitement mélangés sous la forme d'une solution solide ou d'un composé défini, appelé eutectique, eutectoïde, péritectique ou péritectoïde selon la manière dont il se décompose en chauffant ;
- mélange solide-liquide ;
- entièrement liquide, sous la forme de deux liquides non miscibles (émulsion), ou d'un seul liquide parfaitement homogène (une seule phase, solution) ;
- mélange liquide-gaz (aérosol, ou bien gaz au-dessus d'un liquide) ;
- gaz (un gaz est toujours homogène pour de faibles variations d'altitude).
Les états ci-dessus sont composés soit d'une phase unique (par exemple liquides miscibles ou gaz), soit de plusieurs phases hétérogènes. On peut tracer de même l'état d'un système en fonction de la pression, de la température et de la composition.
Avec n corps purs, nous avons n concentrations, mais seulement n+1 paramètres indépendants avec la pression et la température ; en effet, la somme des concentrations vaut 100 %, et l'une des concentrations peut se déduire des autres et ne constitue donc pas un paramètre indépendant.
Il faudrait donc un diagramme à n+1 dimensions pour représenter ces n+1 paramètres indépendants (3 dimensions pour deux corps purs, 4 dimensions pour trois corps purs). Pour simplifier la représentation, un nombre suffisant de paramètres sont fixés afin de tracer un diagramme à deux dimensions ; on considère souvent les diagrammes suivants :
- pour une composition donnée, le diagramme de phase pression-température (P, T), similaire à ce qui a un diagramme de corps pur ;
- pour une pression donnée et deux corps purs, le diagramme binaire composition-température (c, T) ;
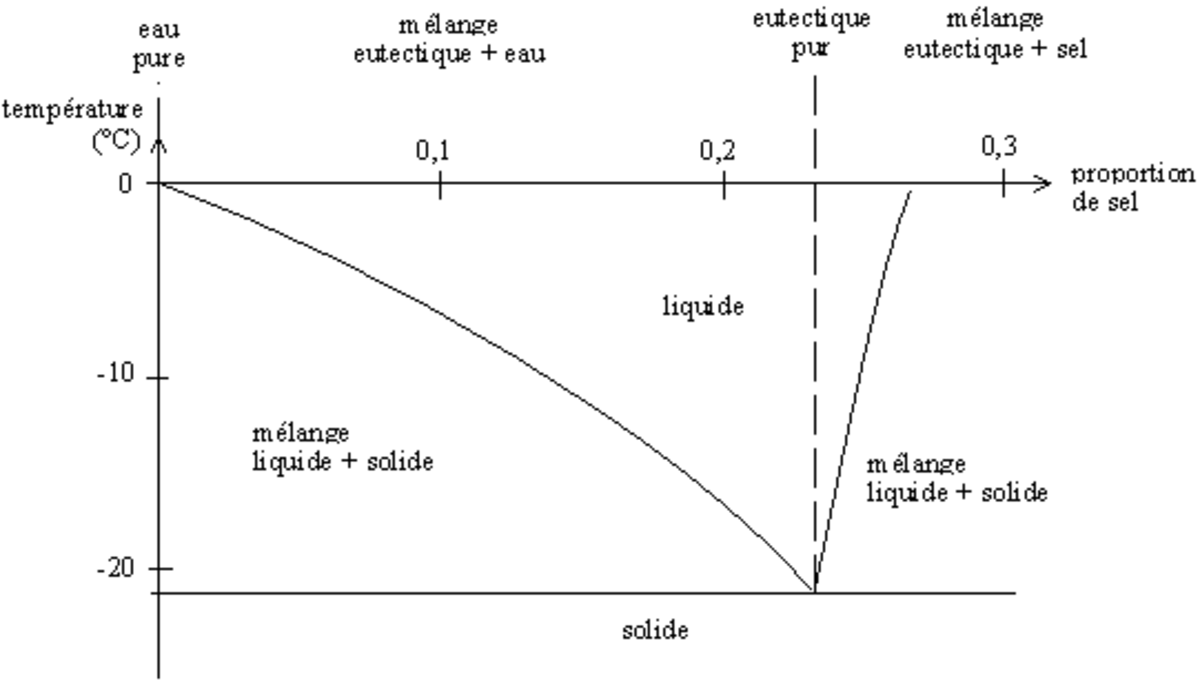
- pour une pression et une température données et trois corps purs, le diagramme ternaire (c1, c2), c'est-à-dire la phase en fonction de la composition ; par habitude, et bien que l'on ait c3 = 1-c1-c2, on trace ce diagramme dans un triangle équilatéral (c1, c2, c3)
Diagramme à solution solide unique
Dans certains cas, comme par exemple pour les alliages argent-or, il n'y a pas de composé défini. Dans ces cas-là, le diagramme binaire est comme illustré ci-dessous :
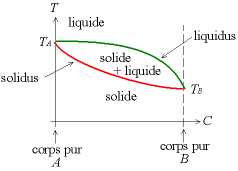
On a
On définit :
- le liquidus : au-dessus de cette courbe, le produit est entièrement liquide ; le liquidus définit la composition du liquide qui est à l'équilibre avec un solide à une température donnée.
- le solidus : en dessous de cette courbe, tout le produit est solide ; le solidus définit la composition d'un solide qui est en équilibre avec un liquide à une température donnée.
Entre le liquidus et le solidus, il y a un mélange solide-liquide. Ce diagramme permet de prédire la manière dont va se passer une solidification.
Composés définis
Les composés définis sont des composés dont le changement de phase se fait à température constante. On distingue :
- les eutectiques : un eutectique fond à température constante, il se comporte comme un corps pur ;
- les eutectoïdes : les eutectoïdes subissent une transformation de phase solide-solide à température constante ; la seule différence avec les eutectiques est que la phase au-delà de la température limite n'est pas liquide ;
- les péritectiques : il y a une transformation solide A → solide B + liquide à température constante ;
- les péritectoïdes : il y a une transformation solide A → solide B + solide C à température constante.


















































