Déplacement d'équilibre - Définition
La liste des auteurs de cet article est disponible ici.
Influence de la pression : Loi expérimentale de Le Chatelier
La réaction s'effectue à température constante dans une enceinte fermée.
Énoncé
« Une augmentation de pression appliquée à un système fermé en équilibre et maintenu à température constante provoque un déplacement d'équilibre, voire une rupture d'équilibre dans le sens pour lequel la réaction s'accompagne, à température et pression constantes, d'une diminution de volume. »
En pratique
Si la pression s'élève, un équilibre chimique qui présente des gaz dans ses produits ou réactifs verra la réaction qui consomme le plus de gaz (et donc en produit le moins) favorisée. L'équilibre va évoluer dans le sens de la diminution des phases gazeuses (si elles existent). Il s'agit encore d'une particularisation du principe de Le Chatelier.
Démonstration
On applique au système une variation de pression dp ( dp > 0 ). On suppose
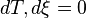
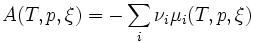
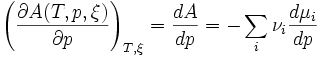
Or G est une fonction d'état, on peut lui appliquer le théorème de Schwarz:
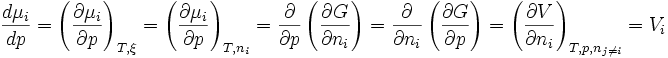
donc
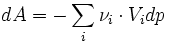
Il s'agit de la définition de
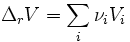
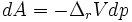
D'après la condition d'évolution naturelle, 
Donc  et
et 
Si le mélange ne comporte que des phases condensées
Les variations de volume en fonction de la pression sont négligeables. Il n'y a donc pas de déplacement d'équilibre.
Si le mélange comporte des phases condensées et des phases gazeuses
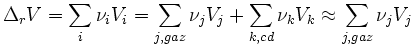
En considérant les gaz comme parfaits :
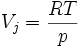
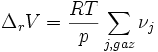
Donc
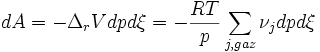

La condition devient :  ou
ou 

















































