Cyanogène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Cyanogène | ||||
|---|---|---|---|---|
| ||||
| Général | ||||
| Nom IUPAC | ||||
| Synonymes | oxalonitrile | |||
| No CAS | ||||
| Apparence | gaz incolore ou gaz comprimé liquefie, d'odeur caractéristique. | |||
| Propriétés chimiques | ||||
| Formule brute | C2N2 NCCN | |||
| Masse molaire | 52,0348 ± 0,002 g·mol-1 | |||
| Propriétés physiques | ||||
| T° fusion | -27,9 °C | |||
| T° ébullition | -21,2 °C | |||
| Solubilité | dans l'eau à 20 °C : 450 ml/100 ml | |||
| Masse volumique | 0,95 g·cm-3 à -21 °C | |||
| Point d’éclair | Gaz Inflammable | |||
| Limites d’explosivité dans l’air | 6,6–42,6 %vol | |||
| Pression de vapeur saturante | ||||
| Point critique | 59,8 bar, 126,85 °C | |||
| Thermochimie | ||||
| Cp | ||||
| Propriétés électroniques | ||||
| 1re énergie d'ionisation | 13,37 ± 0,01 eV (gaz) | |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 11, 23, 50/53, | ||||
| Phrases S : (1/2), 23, 45, 60, 61, | ||||
| | ||||
| ||||
| | ||||
|
4 4 2 | ||||
| | ||||




Danger | ||||
| Écotoxicologie | ||||
| LogP | 0,07 | |||
| | ||||
Le cyanogène (en anglais cyanogen ou carbon nitride) est un gaz incolore dont l'odeur est proche de celle de l'amande.
Le même terme cyanogène, employé comme adjectif, caractérise en médecine la propriété de provoquer une cyanose ("bleuissement de la peau") par diminution de l'oxygénation du sang. On parle par exemple de cardiopathie congénitale cyanogène. En zoologie, il indique la propriété de produire de l'acide cyanhydrique (ex. glande cyanogène).
Propriétés
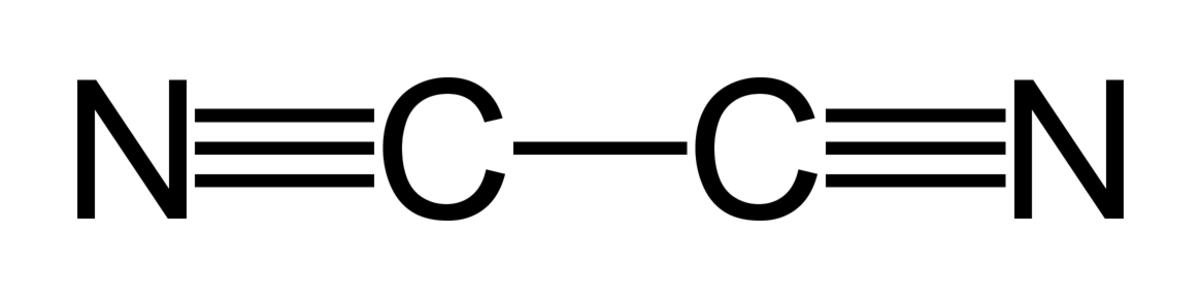
Formule chimique (CN)2 (N≡C-C≡N).
Masse molaire 52.04 g.mol-1
Densité de vapeur 1.8 (air=1)
Température d'autocombustion : >650 degrés C
Il est soluble dans l'eau
Il réagit avec les acides et les oxydants forts (ozone,monoxyde de chlore, chlorates, nitrates, nitrites, fluor) et peut ainsi entraîner une explosion (d'où une possible utilisation comme propergol pour les fusées). Sa combustion en mélange équimolaire avec le dioxygène produit la deuxième flamme la plus chaude à 4525°C (8180°F) après celle du Dicyanoacetylene (N≡C-C≡C-C≡N) à 4990 °C, (9010 °F).
N≡C-C≡N + O2 → N2 + 2 CO
Le cyanogène se polymérise sous l'action de rayons ultraviolets en un solide noir (paracyanogène (CN)x), qui, chauffé en vase clos, se transforme en cyanogène par une réaction limitée et réversible.
Préparation
On peut obtenir le cyanogène en laboratoire par chauffage au rouge du cyanure de mercure ou d'un mélange de cyanure alcalin et de chlorure mercurique. Il s'unit à l'hydrogène pour donner l'acide cyanhydrique.
Combustible, il brûle en donnant de l'azote et, selon la quantité d'oxygène, du gaz carbonique ou de l'oxyde de carbone. Son hydratation est catalysée par les acides et fournit divers produits.
En présence de bases, le cyanogène réagit comme un halogène et donne un mélange de sels d'hydracide et d'acide oxygéné :
(CN)2 + 2KOH → KCN + KOCN + H2O






















































