Cristal liquide - Définition
La liste des auteurs de cet article est disponible ici.
Caractéristiques chimiques des mésogènes
Un mésogène est la molécule à l'origine d'une mésophase.
Morphologie
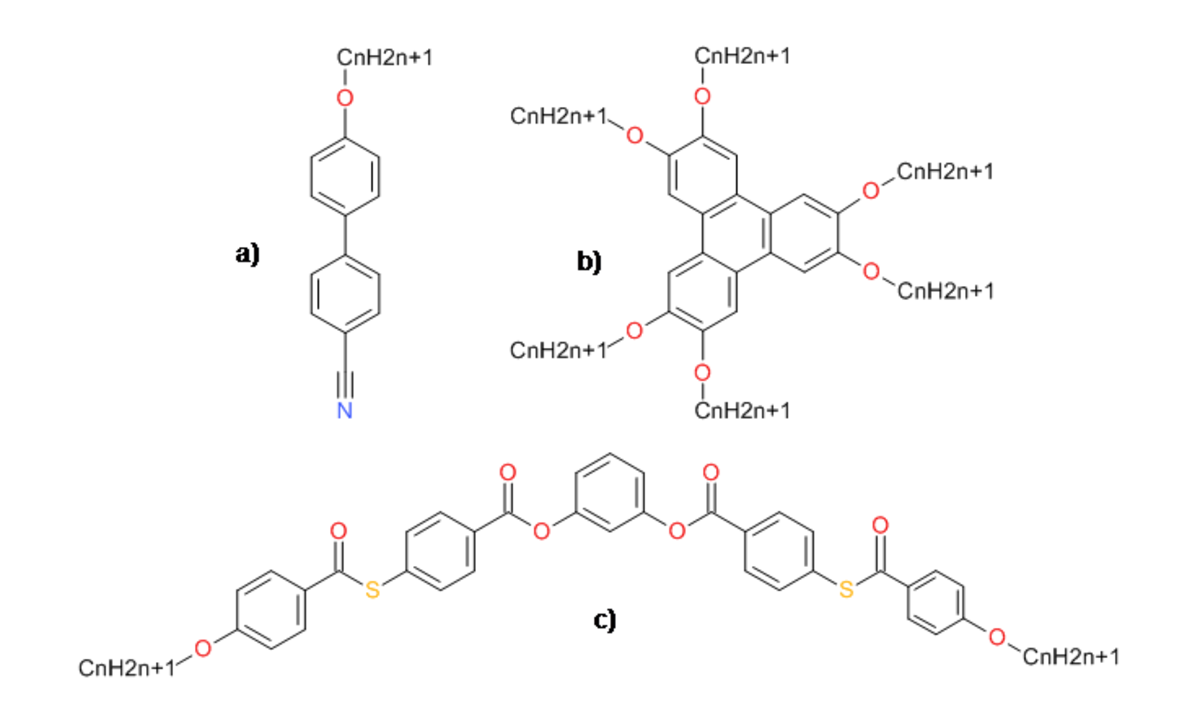
L'existence des mésophases est fondamentalement due à l'anisotropie des mésogènes. L'anisotropie des molécules est répercutée à plus grande échelle au niveau des forces responsables de l'ordre dans le cristal liquide, et lors d'un processus thermique celles-ci peuvent varier plus ou moins fortement selon la direction. Ceci donne lieu a des degrés d'ordre intermédiaire au sein du cristal liquide et donc à des mésophases. Les mésogènes ont généralement une forme allongée (mésogènes calamitiques), de disque (mésogènes discoïdes) ou de banane (mésogènes à cœur courbe) mais d'autres formes peuvent également donner naissance à des mésophases.
Ils possèdent une partie rigide, le cœur aromatique (cas des cristaux liquides thermotropes), et une ou plusieurs parties flexibles, généralement des chaînes aliphatiques. La partie centrale est toujours rigide sinon des flexions surviendraient et empêcheraient la formation de mésophases. Les extrémités sont flexibles. Pour les cristaux liquides lyotropes (détaillés plus loin), la partie rigide est substituée par un ion, c'est le cas par exemple des phospholipides, sur lequel sont greffées une ou plusieurs chaînes alkyl.
Structure chimique
À cette anisotropie géométrique peut s'ajouter une anisotropie chimique si les parties rigide et flexible sont respectivement polaire et apolaire, la molécule est dite alors amphiphile ou amphipathique. Les cycles aromatiques contribuent aux propriétés mésomorphes par la rigidité qu'ils induisent dans la molécules ainsi que par la grande polarisabilité des électrons du noyau benzénique, augmentant les forces de van der Waals susceptibles de rendre stables les mésophases. La dichotomie entre les deux parties donnent naissance à une situation de frustration qui induit une ségrégation de chaque partie lorsque une grande quantité de ces molécules sont en solution : les parties rigides polaires se rassemblent ainsi que les parties flexibles apolaires. Ces propriétés sont dites supramoléculaires car elles sont dues principalement à des intéractions faibles entre molécules comme la gêne stérique, les forces de van der Waals ou le π-stacking. Ce comportement donne naissance à des systèmes auto-organisés qui sont à l'origine des mésophases.
| Thermotropes | Lyotropes | |
|---|---|---|
| Structure | 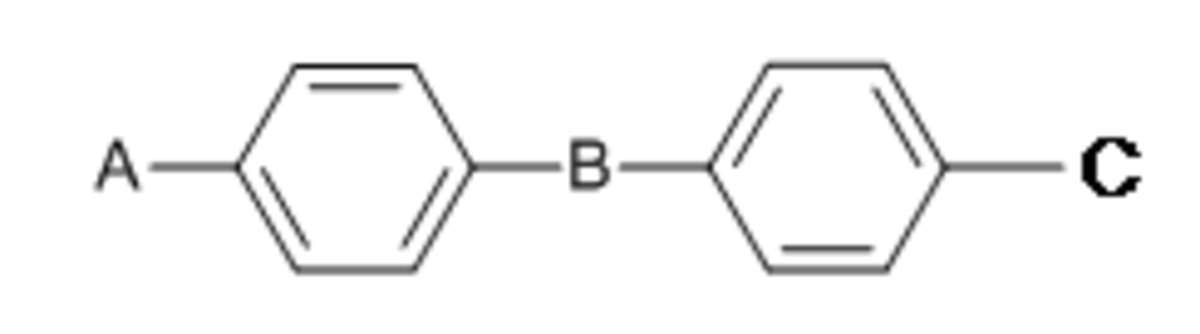 |  |
| Légende | A : groupe orienteur (cyano, nitro, méthyle, halogène…) B : groupe pontant (souvent linéaire) (alcène, ester…) C : alcane polyéthers CnH2n+1 ou per-fluorés CnF2n+1 | Une tête polaire plus une ou plusieurs chaînes grasses. |
| Remarques | Parfois A = C = chaîne alkyle | Monocatenar : 1 chaîne Bicatenar : 2 chaînes Tricatenar : 3 chaînes |
| Bolaforme | 2 parties rigides reliées par une chaîne flexible | 2 ions reliés par une ou 2 chaînes flexibles |
| Gemini | chaîne - rigide - chaîne - rigide - chaîne | chaîne - ion - chaîne - ion - chaîne |
Étude d'un exemple
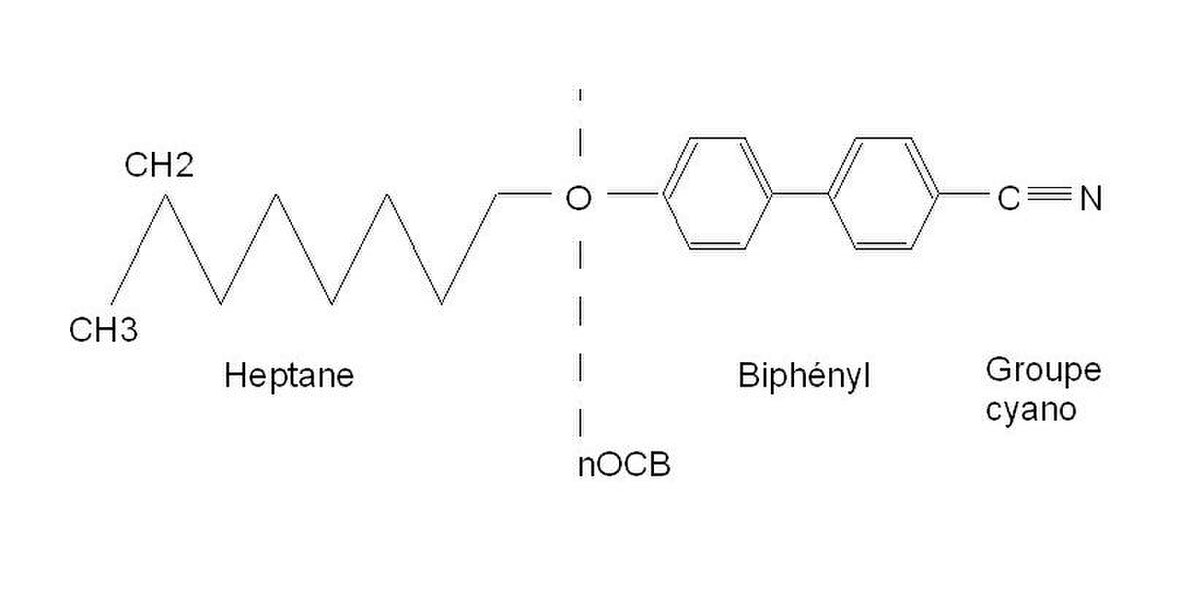
À titre d'exemple, considérons la molécule de 7OCB (heptyloxycyanobiphényl) représentée sur la figure ci-contre. Cette molécule est un assemblage au moyen d'une liaison chimique de deux molécules très différentes. L'heptane est un alcane, il se présente sous forme liquide entre -91 °C et 98,4 °C. La seconde partie est reliée à la première par un atome d'oxygène, il s'agit d'une molécule de cyanobiphényl. Le cyanobiphényl se liquéfie à 88 °C, cette molécule comporte un moment dipolaire permanent et est polarisable. Ces propriétés permettent d'expliquer l'attraction beaucoup plus importante entre les molécules de cyanobiphényl et ainsi la température de liquéfaction plus élevée que dans le cas de l'heptane. Les propriétés très différentes de ces deux molécules liées font naître une situation de frustration lorsqu'elles sont réunies par une liaison chimique covalente, on dit aussi qu'elles sont amphiphiles. La formation d'une structure intermédiaire entre le liquide et le solide, la mésophase, est la réponse à cette frustration. Lorsque la température s'élève, le 7 OCB est dans la phase cristalline en deçà de 54 °C, puis apparaît la phase nématique, il devient liquide isotrope à 74 °C (CR 54 N 74 I). La présence de l'atome d'oxygène a une certaine importance, sa présence augmente les températures des transitions Cristal-Nématique et Nématique-Liquide isotrope par rapport à la molécule de 7CB (Cr 30 N 42,8 I). Les cycles aromatiques contribuent aux propriétés mésomorphes par la rigidité qu’ils induisent dans la molécule ainsi que par la grande polarisabilité des électrons du noyau benzénique, augmentant les forces de van der Waals susceptibles de rendre stables les mésophases. Dans les afficheurs à cristaux liquides, on mélange généralement plusieurs produits dans les proportions eutectiques de manière à obtenir la phase voulue dans la gamme de température d'utilisation. Lorsqu'on allonge la chaîne aliphatique, à partir de n=8, il apparaît une phase supplémentaire entre la phase cristalline et la phase nématique : la phase smectique. Des molécules de forme différente, comportant des cycles sont à l'origine des phases discotiques. Ces molécules ont particulièrement été étudiées par Chandrasekhar.