Cristal liquide - Définition
La liste des auteurs de cet article est disponible ici.
Les mésophases
La physique de base nous enseigne que les états de la matière sont l'état gazeux, liquide et solide. Mais de nombreuses substances organiques ne présentent pas une transition unique entre l'état liquide et solide mais plusieurs transitions faisant apparaître des états intermédiaires : les mésophases ou plus communément cristaux liquides. Un cristal se caractérise par un empilement régulier de molécules, atomes ou ions sur un réseau périodique dans les trois directions de l'espace. Les corrélations de position sont dites à longue portée. Au contraire un liquide ne possède qu'un ordre à courte portée qui s'estompe exponentiellement avec la distance.
Les cristaux liquides possèdent quant à eux un ordre en orientation ou position à longue portée tout un conservant un désordre de type liquide dans l'une au moins des directions de l'espace. Ce sont donc des systèmes possédant un nombre de symétries intermédiaire entre ceux des phases solides et liquides. Il existe de nombreuses mésophases qui différent par le type et le degré d'auto-organisation des molécules. Ce comportement directionnel collectif dépend de la nature et la structure des mésogènes mais également d'un certain nombre de paramètres extérieurs comme les forces mécaniques, électriques ou magnétiques. Ces systèmes auto-organisés sont également sensibles à la température, solides à basse température, et liquides à haute température. Ce phénomène peut, par exemple, être observé sur des écrans portables quand il fait très chaud ou très froid.
Il existe deux grandes classes de cristaux liquides : les cristaux liquides thermotropes, les cristaux liquides lyotropes. Les thermotropes changent de phase en fonction de la température tandis que les lyotropes sont des substances dans lesquelles les mésophases sont induites par la présence d'un solvant et dépendent de la concentration comme de la température. Sont dites amphotropes les molécules permettant de générer des phases thermotropes ainsi que des phases lyotropes en présence de solvant, de nombreuses molécules ont cette propriété.
Les différentes mésophases peuvent être distinguées par leurs propriétés optiques différentes (comme la biréfringence). Vu dans un microscope sous lumière polarisée, un matériau à cristaux liquides semblera être composé de zones de texture distincte. Chaque « zone » correspond à un domaine où les molécules sont orientées dans une direction différente.
Cristaux liquides thermotropes
Le paramètre d'état est la température. Les différents types de mésophases se caractérisent par l'ordre qu'on y trouve, ordre de position, ordre d'orientation, corrélation à courte et à longue distance. Par exemple, un cristal liquide peut couler comme un liquide, mais à la différence du liquide, les molécules ont un certain niveau d'ordre et sont orientées comme dans un cristal (notion de directeur). Les différentes phases des cristaux liquides peuvent être distinguées par leurs propriétés physiques différentes (comme la biréfringence).
Les mésophases thermotropes sont classifiées selon leur degré d'ordre et suivant la morphologie et la structure chimique des mésogènes.
Les phases calamitiques
Les phases calamitiques (du grec calamos, roseau) sont toutes les phases ayant pour origine un mésogène calamitique.
Les phases nématiques et cholestériques

La phase nématique (du grec matos, fil) est la mésophase la plus proche du liquide isotrope. Les molécules possèdent uniquement un ordre d'orientation. La transition de phase liquide isotrope-nématique est caractérisée par ce paramètre d'ordre : l'orientation moyenne des molécules. Il ne faut pas imaginer les molécules figées comme dans un cristal, elles diffusent comme dans un liquide mais conservent globalement une direction unique.
La morphologie des molécules donnant lieu à une phase nématique est constituée d'une partie rigide, des cycles aromatiques par exemple, et d'une extrémité flexible comme une chaînes grasses.
Si les nématiques sont chiraux (cas des esters de cholestérol de Reinitzer), ils peuvent s'arranger de manière périodique, en hélice. Cette phase est appelée phase nématique hélicoïdale (ou phase cholestérique), elle est caractérisée par le pas « cholestérique », c'est-à-dire la distance entre deux couches parallèles, une fois que les molécules ont fait un tour complet sur elles-mêmes. Il est important de noter que les couches sont « virtuelles » car la rotation est continue le long du directeur. Typiquement, le pas varie du dixième de micron au micron, il est donc de l'ordre de grandeur des longueurs d'ondes du domaine visible. Cette caractéristique donne à cette phase des propriétés optiques utilisées dans diverses applications.
Les phases smectiques et smectiques chirales
La phase smectique correspond à des molécules organisées en couches. Elles possèdent donc, en plus d'un ordre d'orientation, un ordre de position, de par ce fait la phase smectique est plus organisée que la phase nématique et donc d'avantage proche de l'état solide cristallin. Dans ces couches, les molécules peuvent se déplacer comme dans un liquide, mais le saut d'une molécule d'une couche à une autre demande une énergie beaucoup plus élevée. Au sein de la couche, les molécules tendent à garder une orientation commune. L'ordre d'orientation entre deux couches successives n'est pas systématique, différents types de phases smectiques existent. Les molécules peuvent ainsi être perpendiculaires aux couches (smectique A) ou inclinées par rapport au plan des couches (smectique C), posséder ou non des ordres de liaison ou de position à l'intérieur des couches. Toutes ces possibilités donnent lieu à un très grand nombre de mésophases smectiques de A à K plus O et Q avec plusieurs sous-catégories.
La morphologie des molécules donnant lieu à une phase smectique est constituée d'une partie centrale rigide, des cycles aromatiques par exemple, et de deux extrémités flexibles comme des chaînes grasses. Généralement, plus les chaînes sont longues plus le polymorphisme du cristal liquide est riche et exclusivement smectique.
La présence de molécules chirales dans certaines phases smectiques telles que la C induit une torsion d'orientation d'une couche à l'autre, une bonne comparaison serait un vecteur oblique tournant autour d'un axe vertical formant ainsi un cône. La mésophase prend alors le nom de « Smectique C* ». La chiralité des molécules dans d'autres phases telles que la A ne conduit quant à elle à aucun changement.
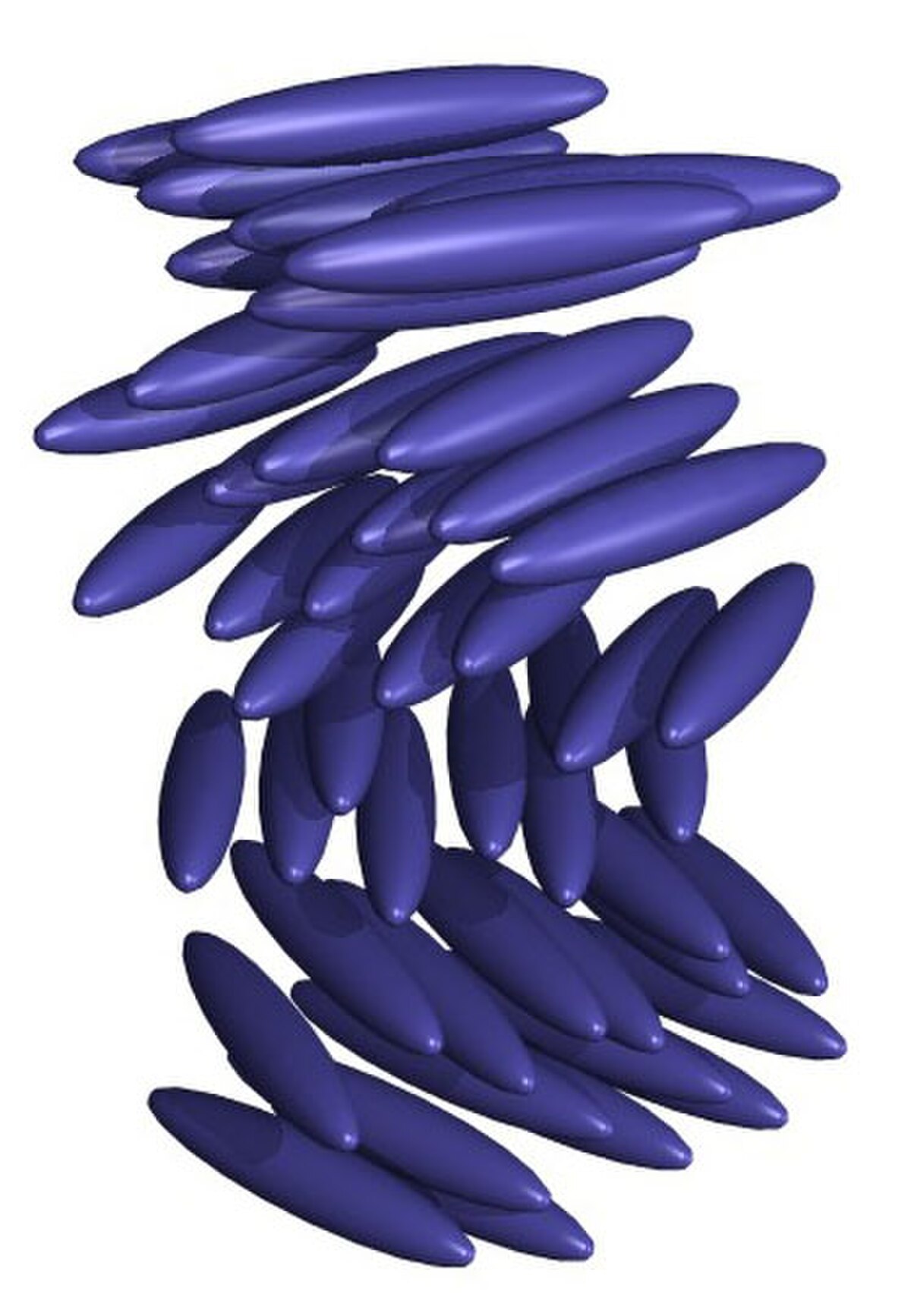
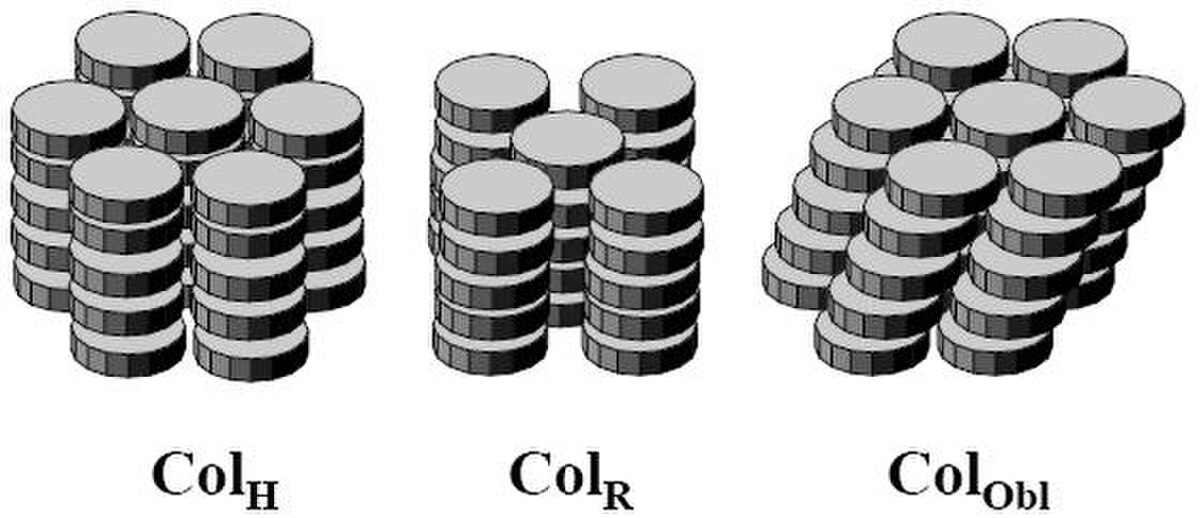
Les phases discoïdes
Les molécules discoïdes peuvent former des phases « nématiques discotiques » ou « cholestériques discotiques » mais elle peuvent aussi s'empiler pour former des phases colonnaires de géométrie variable : verticale, oblique... Les colonnes sont fluides en ce sens que les distances entre deux molécules d’une même colonne fluctuent plus ou moins fortement et qu’il n’y a pas d’ordre à grande distance. D’autre part il n’existe aucune corrélation de position entre les molécules appartenant à deux colonnes voisines. Les mésophases colonnaires ont été beaucoup moins étudiées que les autres mésophases, ceci est peut-être dû au manque de actuel de lisibilité quant aux applications.
Cristaux liquides lyotropes
Les paramètres d'état sont la température et la concentration. Un cristal liquide lyotrope est une solution de plusieurs espèces comportant des propriétés de cristal-liquide dans une certaine gamme de concentration et de température. Par rapport aux cristaux liquides thermotropes, les lyotropes ont un degré de liberté supplémentaire : la concentration, ce qui leur permet d'induire une riche variété de phases. Dans ces phases lyotropiques, les molécules de solvant remplissent l'espace entre les autres composants et apportent de la fluidité au système.
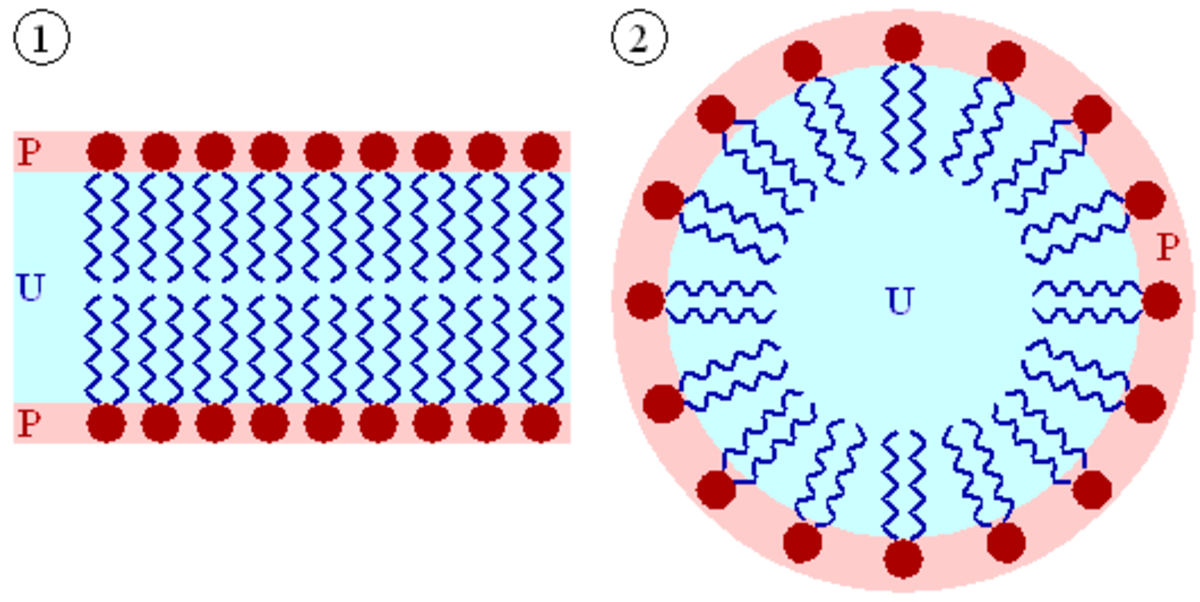
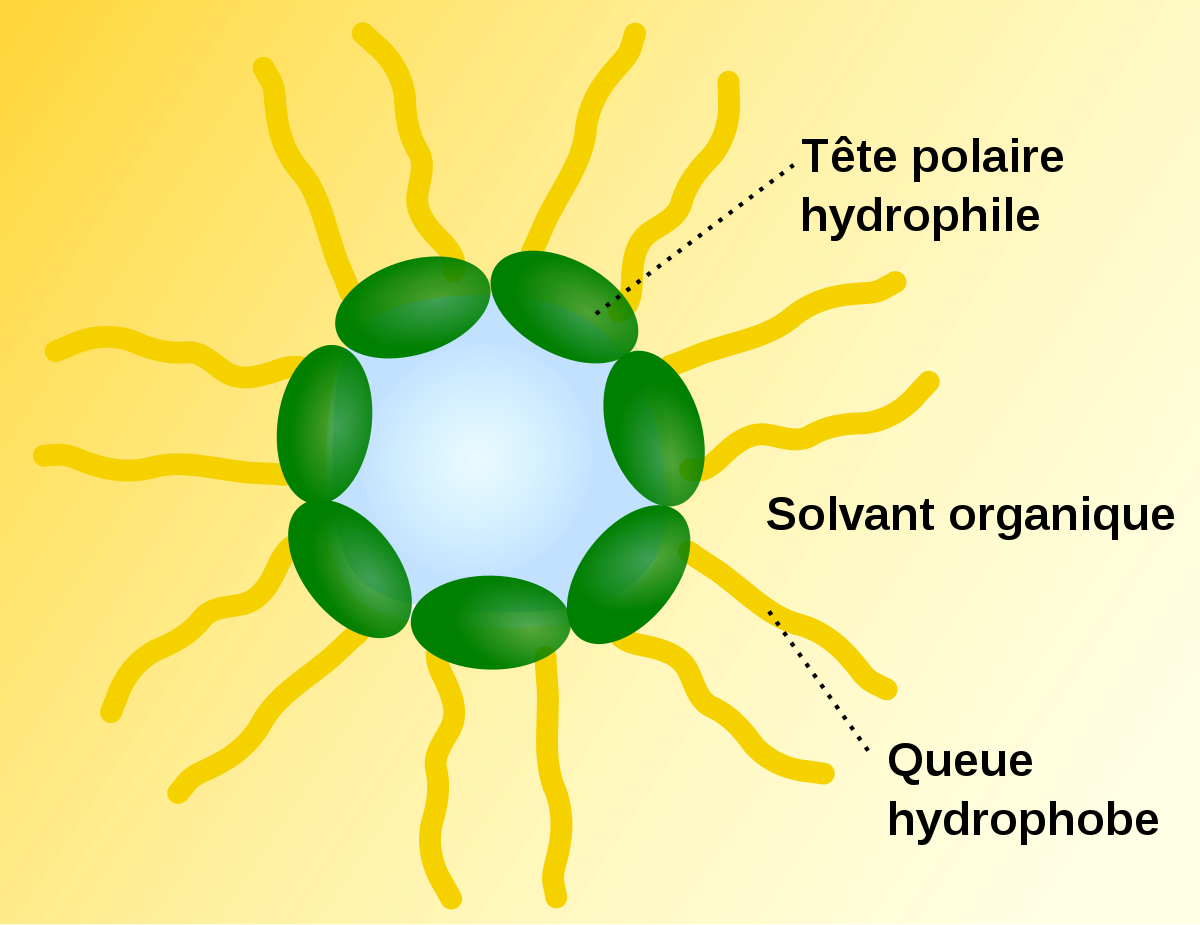
Une molécule possédant une partie hydrophile et une partie hydrophobe est appelée amphiphile ou molécule de surfactant car ces molécules aiment se situer aux interfaces et réduisent l'énergie nécessaire à la création de surfaces. De nombreuses molécules amphiphiles en solution montrent des phases lyotropes. La nature moléculaire du solvant est déterminante pour la structure du fluide. Le savon est l'exemple typique d'un cristal liquide lyotrope. Les phospholipides, composant les membranes biologiques sont aussi des cas remarquables de molécules amphiphiles : les deux acides gras forment une queue hydrophobe et le groupement phosphate une tête polaire.
Dans un solvant polaire comme l'eau, à très faible concentration en surfactant, les molécules sont dispersées, il n'y a pas d'ordre apparent. En augmentant un peu cette concentration, les molécules amphiphiles s'assemblent spontanément pour former des structures sphéroïdales, les micelles. Les parties hydrophobes des composés amphiphiles se regroupent à l'intérieur des micelles, exposant les parties polaires au solvant. Ces objets sphériques sont eux-mêmes dispersés dans la solution. À plus forte concentration, un ordre à plus grande échelle apparaît. Une phase typique est la phase colonnaire hexagonale, dans laquelle les molécules amphiphiles s'assemblent pour former de longs cylindres, qui s'arrangent sur un réseau hexagonal. En augmentant encore la concentration, des phases lamellaires apparaissent : les molécules amphiphiles s'assemblent alors tête-bêche, leur partie hydrophobe face à face, formant des bicouches, le solvant se situe entre ces couches. Les membranes biologiques et les liposomes ont une telle organisation. Enfin, à plus forte concentration encore, des micelles dit inverses apparaissent, le solvant étant encapsulé à l'intérieur des structures formées par les molécules amphiphiles.
Beaucoup de fluides communs sont des cristaux liquides lyotropes. Les savons, par exemple, sont des cristaux liquides, qui offrent une grande variétés de phases en fonction de la concentration en eau. Les cristaux liquides sont très présents en biologie, citons par exemple les membranes cellulaires et l'artériosclérose, maladie liée aux transitions de phases des cristaux liquides.
Cristaux liquides métallotropes
Les cristaux liquides métallotropes sont les cristaux liquides possédant un ou plusieurs atomes métalliques dans leur structure moléculaire. La molécule s'appelle alors « métallogène ».