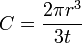Corrosion aqueuse - Définition
La liste des auteurs de cet article est disponible ici.
Les piqûres
Généralités
La formation de piqûres est un phénomène de corrosion qui survient lorsqu'une pièce est protégée contre la corrosion généralisée par un film passif, souvent un oxyde protecteur(par exemple, acier inoxydable ou aluminium).
Il s'agit d'une corrosion localisée. En surface, on ne voit qu'un petit point, mais en dessous, il y une cavité bien plus importante. Ceci entraîne à terme la perforation de la pièce et sa fragilisation.
La formation de piqûres est un phénomène d'autant plus redouté qu'il surprend l'utilisateur : celui-ci a pensé à la corrosion généralisée, il pense être protégé, et la trace extérieure de corrosion est quasiment indétectable.
Mécanisme général
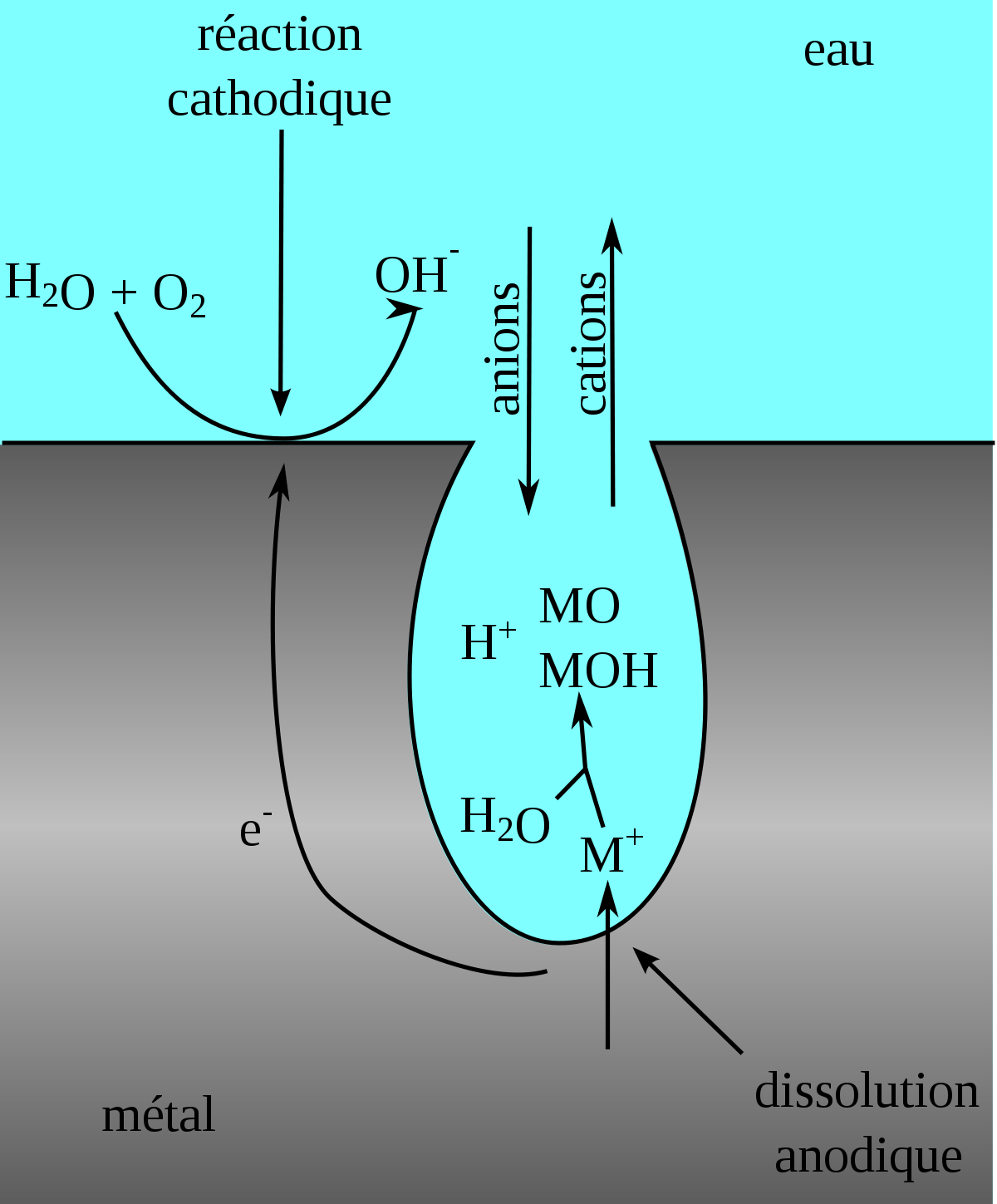
La piqûre commence toujours par une rupture locale du film passif (l'oxyde protecteur formé sur le métal) souvent au droit d'hétérogénéités du métal près desquelles le film est moins stable - par exemple inclusions de type sulfure pour les aciers inoxydables. Ensuite, la propagation est entretenue par deux phénomènes :
- l'intérieur de la piqûre est dépassivé et contient un milieu désaéré, alors que l'extérieur est passivé et en milieu aéré. Il se crée donc un effet de pile entre l'intérieur et l'extérieur, il s'agit en fait d'une corrosion galvanique localisée.
- La réduction de l'oxygène à l'extérieur de la piqûre, sur le métal passif, alimente l'oxydation du métal à l'intérieur, ce qui produit des cations métalliques. Lorsque la concentration en cations augmente se produit une réaction d'hydrolyse, par exemple pour les aciers inoxydables : Cr 3+ + 3H 2O → Cr(OH)3 + 3 H+.
On voit que cette réaction d'hydrolyse libère de l'acidité. La production de cations H+ va entraîner la migration d'anions à l'intérieur de la piqûre afin de rétablir la neutralité électrique, généralement des chlorures, agressifs pour le métal. L'addition de ces deux phénomènes entraîne donc la formation d'un milieu acide et concentré en chlorures, qui à son tour accélère la propagation de la piqûre. Pour les aciers inoxydables, des milieux de pH 0 et de concentration en chlorures d'une mole par litre ont pu être ainsi identifiés dans les piqûres, alors que le milieu externe était proche de la neutralité (pH 7) et peu chargé en chlorures.
Cependant, au bout d'un certain temps, la corrosion ne s'accélère plus car la cinétique devient contrôlée par la diffusion-migration des anions provenant de l'extérieur, alors que les chemin à parcourir s'allonge en raison de la croissance de la piqûre.
Cas de l'aluminium
Le phénomène
L'aluminium est naturellement recouvert d'une couche de protection, ou couche de passivation. Il s'agit d'une couche d'oxyde formée suivant la réaction :
La très forte réactivité de l'aluminium est due à une valeur élevée de l'énergie libre (-1675 kJ)
La piqûration est provoquée par la rupture du film d'oxyde dans un milieu contenant par exemple des ions chlorure (Cl-). La piqûration est influencée par le milieu dans lequel se trouve l'aluminium : acide, nourriture. La composition de l'alliage peut également rentrer en ligne de compte. La présence de cuivre dans l'alliage peut par exemple être une cause de piqûration. Cependant, le milieu extérieur est le facteur dominant
Après la rupture du film protecteur, l'aluminium nu devient une anode où se produit la réaction d'oxydation suivante :
À la cathode sur la surface du métal, nous avons les réactions suivantes :
Globalement, l'aluminium métal se dissout pour former de l'hydroxyde d'aluminium (souvent appelé par erreur alumine dans le langage courant) suivant la réaction :
| Aspect de surface d'un alliage d'aluminium type 7000 avec des piqûres de corrosion. | Aspect de surface d'un alliage d'aluminium type 7000 avec des piqûres de corrosion (après décapage) | Piqûre (gros plan) |
|---|---|---|
| | | |
Vitesse de propagation de la piqûre
La profondeur de la piqûre augmente rapidement au départ, puis la vitesse d'augmentation ralentit avec le temps :
- d: profondeur de la piqûre
- t : temps
- k : constante dépendant de l'alliage et des conditions (température, nature du fluide etc.)
En effet, dans le cas d'une piqûre hémisphérique de rayon r idéale, la quantité de métal dissout pendant un temps t est :
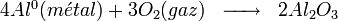
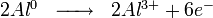
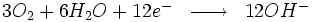
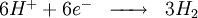
![d=k\sqrt[3]{t}\,\!](https://static.techno-science.net/illustration/Definitions/autres/7/7d81a727dd30260057bc99a0d120f617_5d777644be7c4a11342b5113cfa317c0.png)