Configuration électronique - Définition
La liste des auteurs de cet article est disponible ici.
Configuration d'un état - fondamental ou excité
Il y a plusieurs configurations électroniques pour un même atome ou une même molécule. Si l'état correspondant à la configuration électronique est celui de la plus basse énergie, on qualifiera l'état de fondamental. Dans le cas contraire il sera qualifié d'état excité.
En première approximation l'énergie électronique du système est la somme des énergies associées à chaque électron qui le compose. Ainsi, pour l'état fondamental d'un système la répartition se fait:
- par ordre croissant de l'énergie associée à la spinorbitale considérée.
- en cas d'égalité d'énergie entre spinorbitales, on place les électrons dans les spinorbitales de spin +1/2 avant de peupler les spins -1/2 (Règle de Hund)
Fonction d'onde poly-électronique
Chaque électron d'une configuration est décrit par une unique spinorbitale, produit d'une fonction d'espace (orbitale) par une fonction de spin.
La fonction d'onde d'un état poly-électronique (à n électrons) peut être considérée comme un produit de spinorbitales (produit de Hartree):
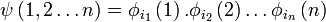
pour un électron k particulier
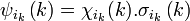
-
-
À cause du principe d'exclusion de Pauli, une orbitale peut contenir 2 électrons selon la valeur de ms. La façon la plus compacte d'écrire la configuration électronique d'un système est celle où les électrons sont notés en exposant de l'orbitale :
- orbitale vide :
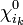
- orbitale monooccupée:
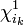
- orbitale bioccupée:
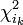
Électron célibataire ou électron appariés
- On dit qu'un électron est célibataire si l'orbitale qui le contient ne contient que lui.
- On dit que deux électrons sont appariés s'ils partagent la même orbitale.
Énergie d'une configuration
L'énergie totale d'un système poly-électronique est la somme des énergies de ses composants et de celle des interactions entre ses composants (répulsion entre électrons par exemple, ou interaction d'échange).
L'énergie associée à un électron correspond à celle de l'orbitale qui le contient. Cette énergie est calculable par des méthodes approchées qui relèvent de la mécanique quantique.
L'importance de la configuration électronique pour les propriétés et les difficultés d'obtention des énergies ont conduit à établir des modèles d'évaluation de l'ordre ou de l'énergie des orbitales ainsi que de l'interaction entre électron (par écrantage par exemple).
Multiplicité de spin d'une configuration
La somme des spins des électrons donne le spin total de la configuration:
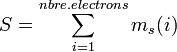
Ce nombre conduit à la multiplicité de spin de la configuration, qui se calcule selon 2S + 1 C'est le nombre de "micro-états" de la configuration électronique. Ainsi une configuration avec deux électrons appariés conduit à un seul micro-état: un singulet car il n'y a qu'une façon de mettre 2 électrons dans la même orbitale. De façon analogue, un électron célibataire conduit à un état doublet car on peut générer 2 micro-états : celui où le spin est vers le haut (ms(i)=+1/2), et celui où le spin est vers le bas (ms(i)=-1/2). Ces micro-états ont la même énergie mais sont différentiables par certaines spectroscopies.
La notion de micro-état des triplets est plus complexe et rentre dans un domaine de spécialistes. Notons cependant l'importance de ces états triplets puisque que la configuration de l'oxygène que nous respirons est un triplet, c'est-à-dire qu'il a deux électrons célibataires. (voir par exemple Oxygène triplet (en anglais) et les orbitales moléculaires de O : OM de O).
Symétrie d'espace d'une configuration
Les termes spectroscopiques rendent compte de la symétrie d'espace d'une configuration électronique. Ces symétries sont particulièrement riches pour les atomes, mais se rencontrent également dans les molécules, en particulier les diatomiques.

















































