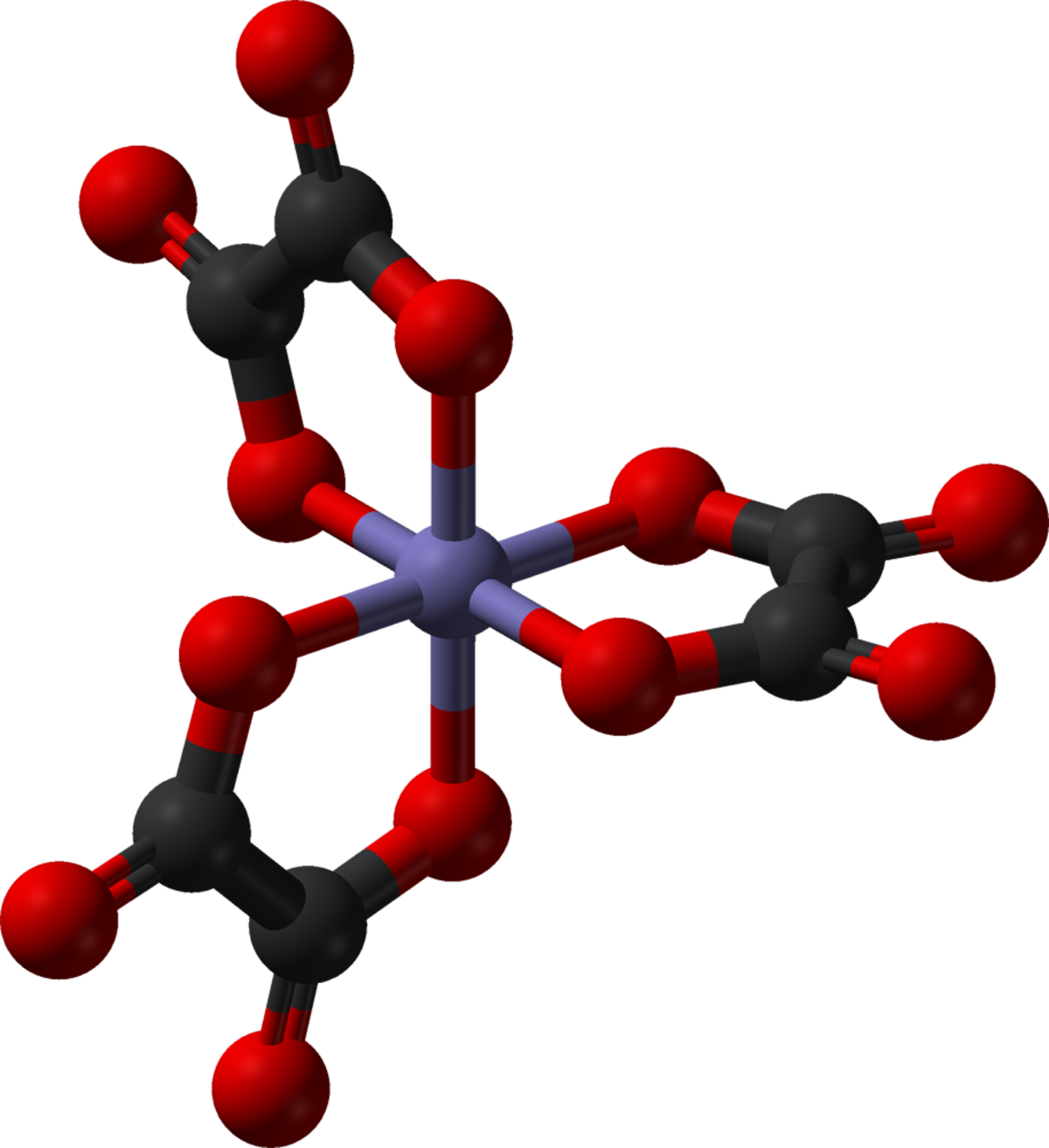
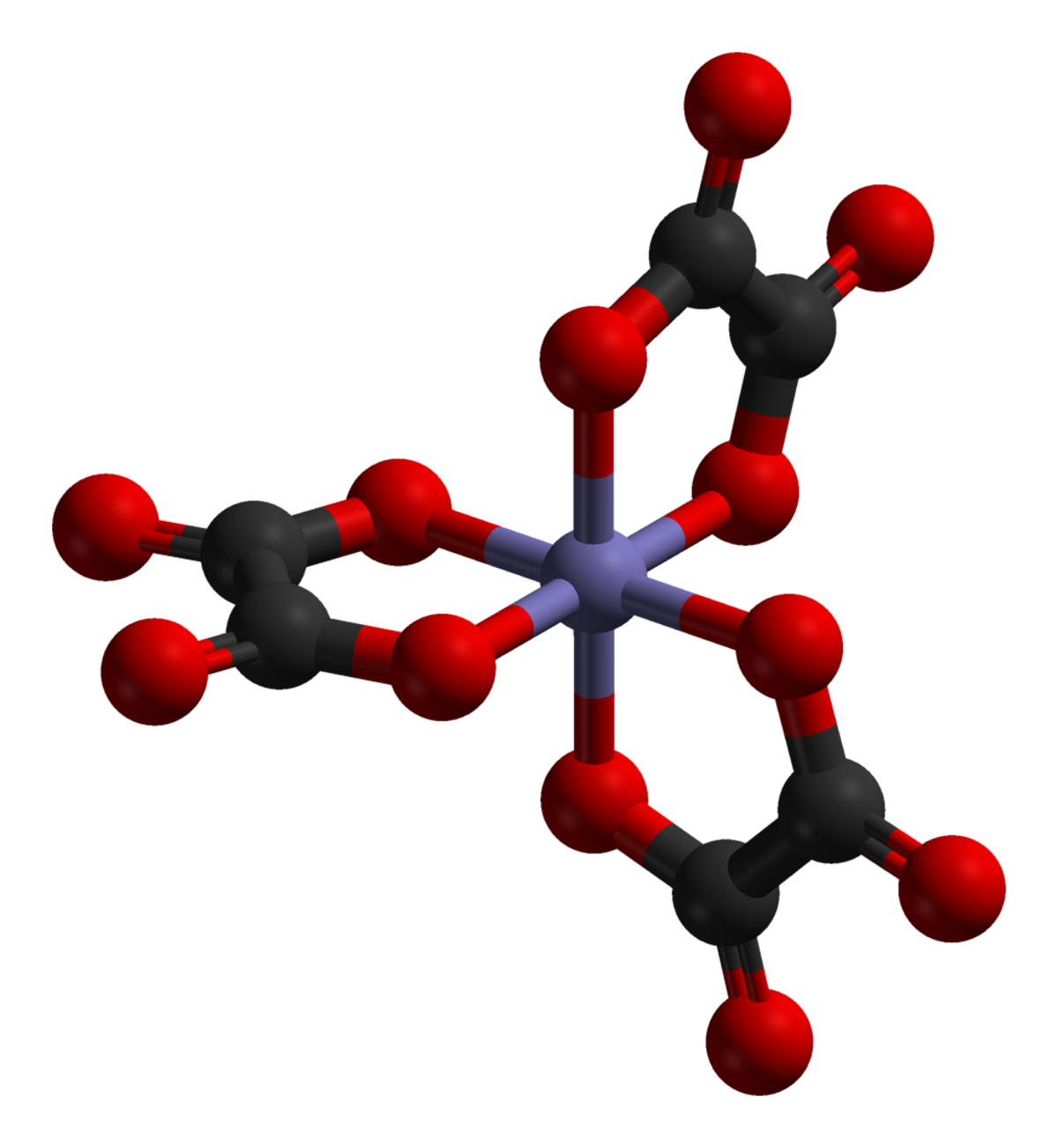
Complexe (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Réactions de complexation
D’une façon générale, la formation d’un complexe à partir d’un métal M et de n ligand L s’écrira :
Mt+ + nLu-⇆ [M(L)n]t-nu+
À cette réaction est associée une constante d’équilibre K:
- Kf: constante de formation qui s'écrit
![K_f = {[M(L)_n] \over [M][L]^n }](https://static.techno-science.net/illustration/Definitions/autres/2/2f02c3ae0a877a2866c4fe780eb64671_b72a0c3c167268b3d92404cc1c178a9b.png)
- Kd: constante de dissociation qui s'écrit
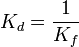
Ces constantes s'expriment de façon approximative en faisant apparaitre les concentrations au lieu des activités des ions (ou molécules) présents à l'équilibre, on n'y fait jamais apparaitre les solides et le solvant(le plus souvent de l'eau) Au Kd, on associe un pKd = − log(Kd).
Plus le pKd est petit moins le complexe est stable.
Exemple: Ag+ + 2NH3 ⇆ [Ag(NH3)2]+
![K_f = {[Ag(NH_3)_2]^+ \over [Ag^{+}][NH_3]^2 }](https://static.techno-science.net/illustration/Definitions/autres/1/14e883310af167b4518fe88225bb51fb_90c080c892e89b80df4c113195dff3fc.png)
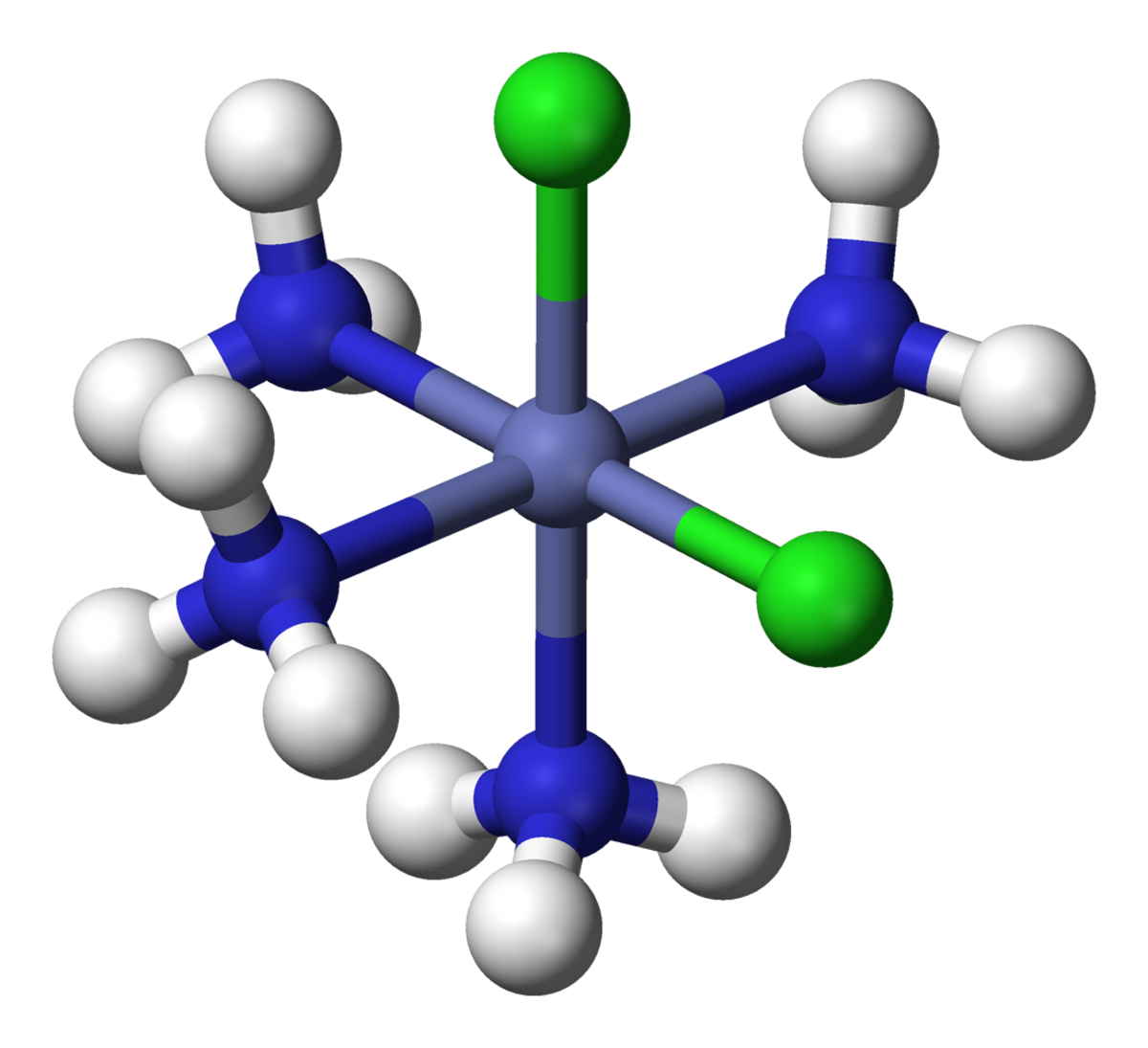
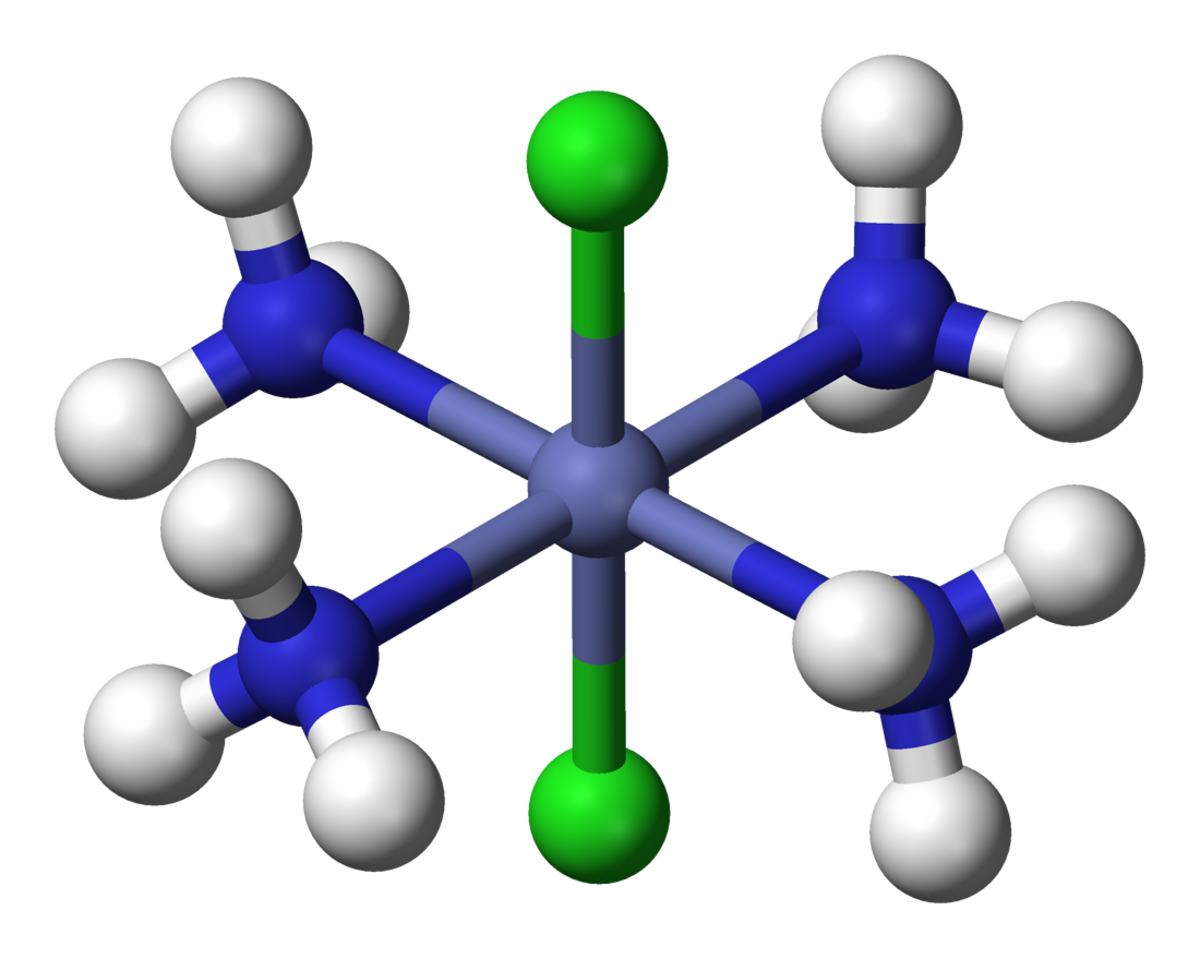
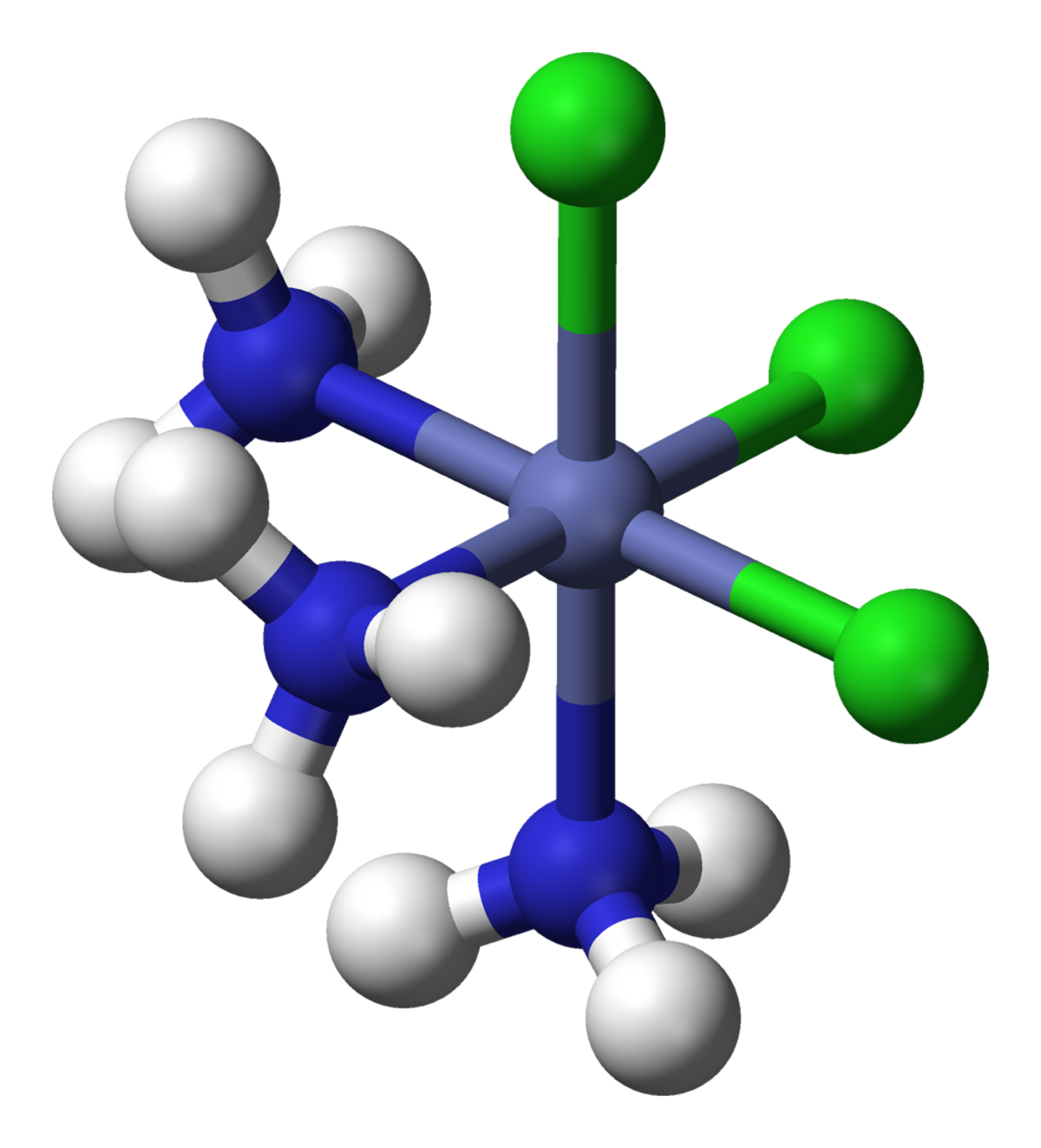
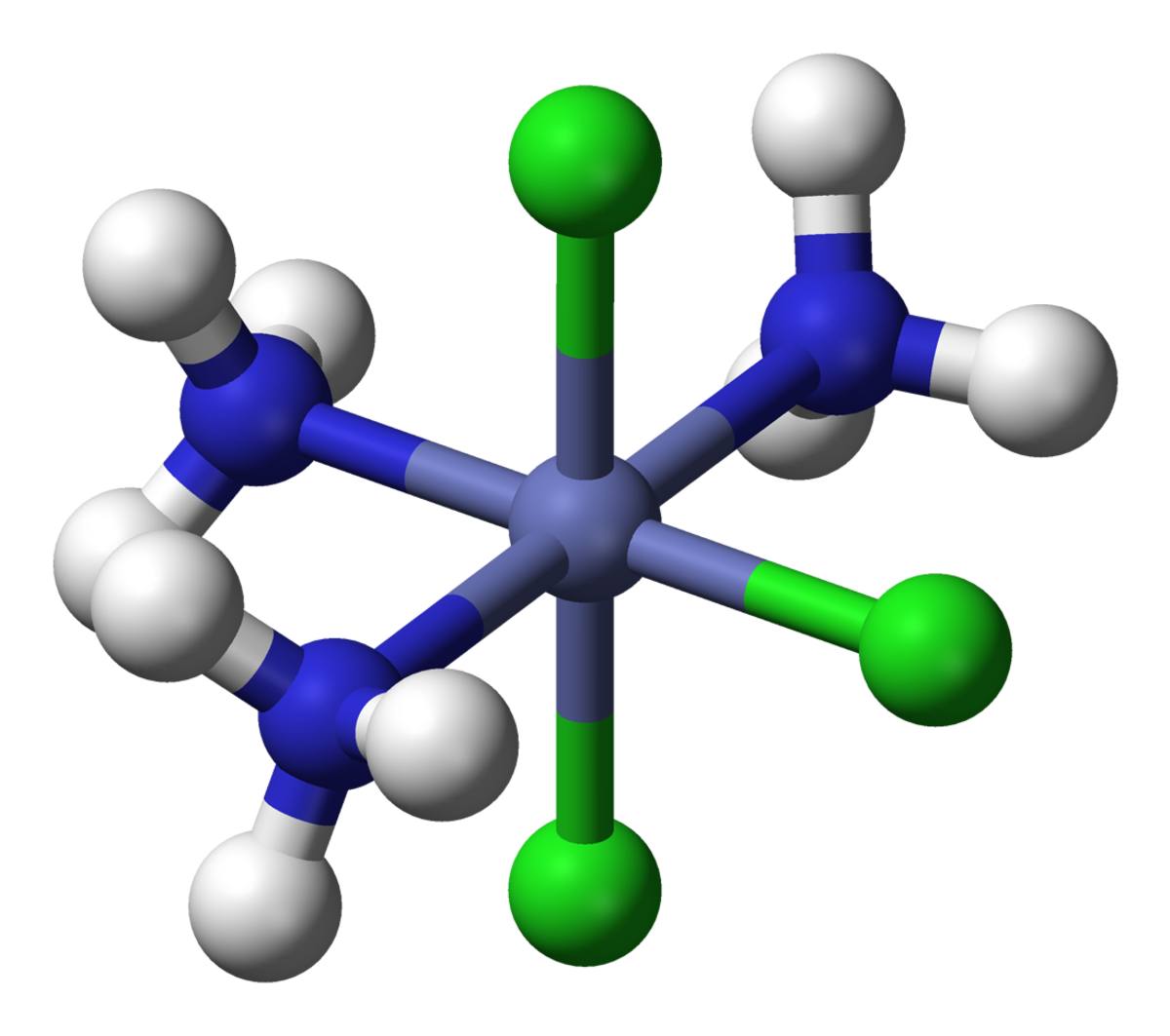
Isomérie
Isomérie Géométrique
L'isomérie géométrique a lieu dans les complexes octaédriques et carrés plans mais pas dans les complexes tétraédriques. Quand, dans de tels complexes, des ligands sont dans des positions adjacentes, on utilise le descripteur cis, et quand ils sont dans des positions opposées, le descripteur trans
Quand trois ligands identiques ou les trois fonctions coordonnantes d'un ligand tridente occupent une face d'octaèdre, on parle d'isomère facial (fac), s'ils occupent une arête de l'octèdre, on parle d'isomère méridional (mer).
Isomérie Optique
L'isomérie optique a lieu lorsque l'image d'une molécule dans un miroir n'est pas superposable avec la molécule originale. Des échantillons pur d'isomères optiques font tourner le plan de polarisation de la lumière polarisée. Les composés dans le tableau suivant sont des exemples de paires d'isomères optiques en chimie de coordination.
| 
|
Applications des complexes
Les complexes métalliques ont une importance capitale en chimie et interviennent dans beaucoup de domaines d'avant-garde.
Les complexes métalliques en catalyse
La configuration des ligands autour d'un centre métallique, la possibilité d'échanger des ligands et la capacité de certains métaux à s'insérer dans des liaisons covalentes (en particulier les liaisons multiples) de façon réversible rend les complexes métalliques extrêmement utiles en catalyse. En effet, la coordination à un centre métallique abaisse l'énergie d'activation de réaction par formation d'un ou plusieurs complexes intermédiaires et influe sur la sélectivité de la réaction. Dans la nature, il y a aussi des complexes métalliques qui interviennent dans les métalloprotéines (fer dans l'hémoglobine, magnésium dans la chlorophylle, cuivre dans l'hémocyanine...). Ces complexes sont un des objets d'étude de la chimie bioinorganique.
Les complexes en chimie des solutions
Les complexes en chimie des solutions ont des utilités multiples:
- Solubiliser un métal contenu dans un minerai (Exemple : l'or solubilisé comme un complexe cyanuré)
- Caractériser la présence d'une espèce chimique par formation d'un complexe coloré.
En médecine
- Des complexes de platine sont utilisés dans le traitement de certains cancers (cisplatine, carboplatine, oxaliplatine…).
- La capacité complexante de l'EDTA est mise à profit dans le traitement d'intoxication par des métaux, le plomb en particulier.
- Des complexes de gadolinium sont utilisés comme agents de contraste en imagerie par résonance magnétique (IRM).
Autres utilisations
- Le complexe Fe(CO)5 liquide à température ambiante permet d'obtenir par distillation du fer très pur.