Cinétique chimique - Définition
La liste des auteurs de cet article est disponible ici.
Les réactions composées
Au cours d'une transformation chimique, plusieurs réactions élémentaires peuvent avoir lieu simultanément ou successivement. On appelle réactions composées des ensembles de réactions élémentaires qui se combinent selon un des trois schémas simples suivants: série, opposé ou parallèle.
Réactions séries
Le ou les produit(s) d'une réaction peuvent eux-mêmes être les réactifs d'une autre réaction. Cela constitue un système de réactions dites séries.
Pour une réaction possédant plusieurs étapes, la vitesse globale de formation du produit final est déterminée par la vitesse de l'étape la plus lente.
Réactions opposées
Certaines réactions peuvent se produire dans les deux sens. On les appelle des réactions opposées. Dans ce cas, le système évolue vers un état d'équilibre dynamique.
Du point de vue macroscopique, la réaction semble terminée puisque la composition du système ne varie plus. Le taux d'avancement α est alors compris entre 0 et 1 et la réaction n'est pas totale. Mais du point de vue microscopique les réactions directes et inverses continuent de se produire avec des vitesses égales.
Réactions parallèles
On appelle réactions parallèles des systèmes de réactions distinctes qui ont les mêmes réactifs mais des produits différents. La vitesse de transformation des réactifs est alors la somme des vitesses de chacune des réactions.
Cinétique d'une réaction élémentaire
Une réaction est dite élémentaire si les réactifs réagissent simultanément en un même point pour donner directement les produits sans former d'espèces intermédiaires. La vitesse de réaction dépend donc de la probabilité de rencontre des réactifs donc de la fréquence des chocs. Cette fréquence est proportionnelle à leur concentration. Par ailleurs, plus la température est élevée, plus les rencontres sont probables (agitation thermique) et plus l'énergie cinétique des réactifs au moment du choc est élevée ce qui permet de franchir la barrière d'activation, donc la température a également un rôle important.
On appelle molécularité le nombre d'entités (molécules, ions) qui entrent simultanément en contact lors d'une réaction élémentaire. Les réactions élémentaires sont dites monomoléculaires, bimoléculaire ou trimoléculaire selon la valeur de leur molécularité (respectivement 1, 2 ou 3). Comme la probabilité que plus de 3 entités se trouvent simultanément en un même point est quasiment nulle, on considère qu'il n'existe pas de réaction élémentaire de molécularité supérieure à 3. (La probabilité de chocs triples étant elle-même très faible, l'existence de réactions élémentaires trimoléculaires est discutée).
Pour une réaction élémentaire, son ordre est égal à sa molécularité.
Par exemple pour une réaction élémentaire : A + B → C (bimoléculaire) La loi de vitesse prendrait la forme :
![v = \frac{-d[A]}{dt} = k \cdot [{\rm A}]\cdot [{\rm B}]](https://static.techno-science.net/illustration/Definitions/autres/8/866da0e34124ddeda4897d9a094cd782_f6e4542b6a5dec17f1e4ddb01ec0f26e.png)
k est le coefficient de vitesse dépendant notamment de la température et éventuellement d'autres facteurs physiques.
Mécanisme par stades
Aussi appelé séquence ouverte, les réactions se produisent dans un ordre donné, toujours le même, des réactifs aux produits.
Mécanisme en chaîne
Aussi appelé séquence fermée. Ici, un intermédiaire réactionnel (ou centre actif) est régénéré au bout d'un certain nombre d'étapes qui se reproduisent de manière cyclique. Ainsi le centre actif pourra faire réagir un grand nombre de réactifs. Le centre actif met en jeu des intermédiaires réactionnels qui pourront être calculable par le principe de Bodenstein.
Un exemple de mécanisme en chaîne droite est la substitution nucléophile de type 1.
Il arrive que la chaîne de réaction soit ramifiée (i.e. plusieurs centres actifs, comme dans les oxydations) et cela entraîne souvent des réactions explosives dues au multiplications des centre réactifs et à l'énergie dégagée lors des terminaisons.
La longueur de chaîne l est définie comme le nombre de cycles que peut effectuer en moyenne un radical à partir de sa formation avant d'être détruit.
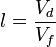
- Vd = Vitesse de disparition des molécules produisant les radicaux
- Vf = vitesse d'initiation ou vitesse de formation du radical par les méthodes d'initiation

















































