Chiralité (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Un objet chiral, deux énantiomères
Un objet chiral ne possède que deux formes différentes possibles appelées énantiomères (du grec enantios « opposé »). Ainsi une chaussure est un objet chiral avec deux énantiomères : la chaussure droite et la chaussure gauche.
C'est exactement pareil pour les molécules : dès qu'une molécule possède une symétrie suffisamment basse, elle existe nécessairement sous la forme de deux énantiomères qui ont les mêmes propriétés physiques symétriques (solubilité, température d'ébullition, etc.) ; ils peuvent cependant être différenciés par une propriété optique, la déviation de la lumière polarisée : l'un des composés la dévie à droite et l'autre à gauche. Par exemple, l'acide lactique existe en deux formes énantiomères : l'acide lévo-lactique et l'acide dextro-lactique.
Nomenclature
Au XIXe siècle, on a montré que certains composés en solution dévient le plan de polarisation de la lumière polarisée. Il y en a qui le dévient à gauche (angle -α) et d'autres à droite (angle +α). Et c'est le cas pour nos énantiomères : il y en a un qui dévie la lumière à droite, il est dit dextrogyre (d), et l'autre qui la dévie à gauche, il est lévogyre (l) au même degré. Ceci permet de les différencier. La nomenclature / fait référence elle à la configuration absolue, c'est-à-dire à l'arrangement spatial du composé par référence à l'alanine, un des acides aminés naturels.
Un mot sur la nomenclature utilisée pour désigner la configuration d'un centre de chiralité (l'arrangement dans l'espace des substituants de l'atome tétravalent) : les chimistes disent R/S pour « Rectus, droit » ou « Sinister, gauche » (nomenclature officielle de Cahn-Ingold-Prelog), mais les biologistes continuent d'utiliser l'ancien système /. Le premier système est fondé un ordre de priorité convenu des quatre différents substituants du carbone asymétrique ; le système / est une désignation graphique dû à Emil Fischer et utilise, pour établir la désignation à donner à une molécule chirale, des corrélations chimiques compliquées à partir du glycéraldéhyde. Il n'y a aucune relation entre les deux systèmes, qui sont basés sur des critères totalement différents. De plus, dans les deux cas, il n'y a aucune relation entre la configuration et les propriétés optiques (dextrogyre ou lévogyre).
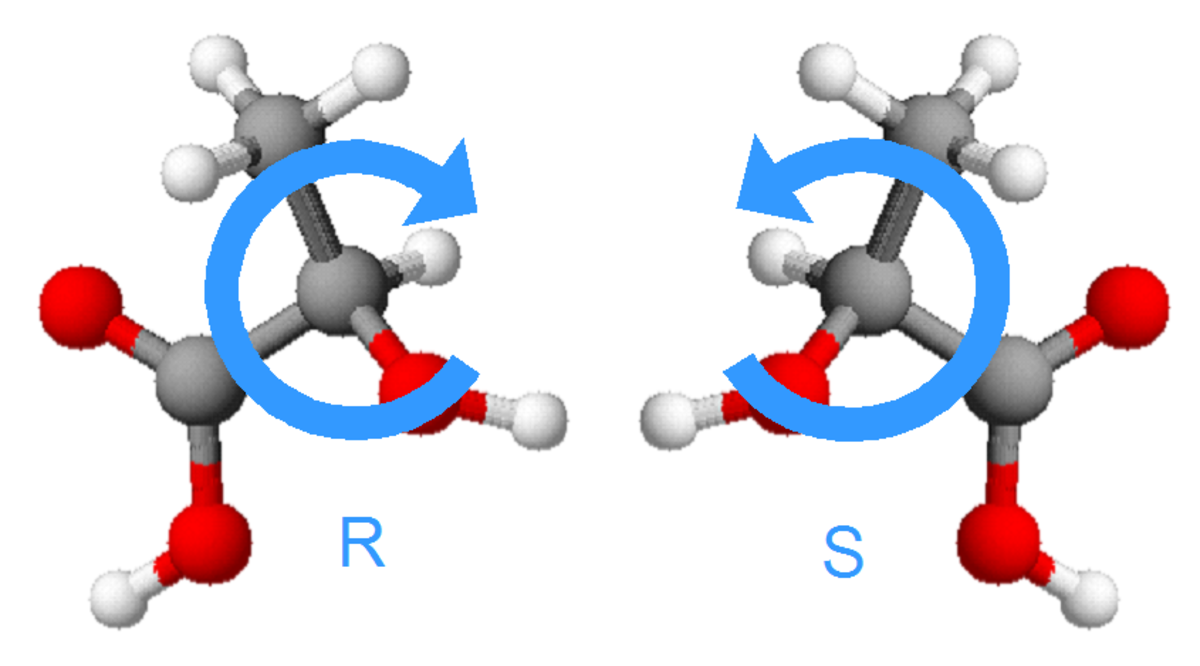
Règles de Cahn, Ingold et Prelog
La nomenclature R/S définit la configuration absolue puisqu'elle est applicable à tous types de molécules, sur le base de critères non-ambigus. À chaque carbone asymétrique (C*) est attribué un descripteur R ou S en donnant à chacun de ses substituants une priorité selon le numéro atomique de l'atome lié au C* (la plus grande priorité étant accordée au substituant titulaire du numéro atomique le plus élevé). Si deux substituants sont liés au C* par le même atome, il faut, pour attribuer la priorité, se référer aux autres atomes liés à ce dernier, et ainsi de suite. Ensuite, il s'agit de savoir si les trois substituants prioritaires sont présentés d'une façon horaire (en plaçant conventionnellement le substituant le moins prioritaire à l'arrière) ou anti-horaire. L'isomère R est donc vers la droite, soit une configuration où les substituants prioritaires « tournent » dans le sens horaire. L'isomère S correspond à la rotation anti-horaire. Plusieurs carbones peuvent être asymétriques, donc pour présenter le nom complet de la molécule, on ajoute, devant le nom de la molécule (xR, yS)-, où x et y sont les numéros de position des carbones asymétriques et R et S sont les configurations possibles à chaque carbone chiral. On peut donc avoir du (2S,5R)-5-chlorohexan-2-ol, du (2S,5S)-5-chlorohexan-2-ol, du (2R,5R)-5-chlorohexan-2-ol ou encore du (2R,5S)-5-chlorohexan-2-ol. Parmi ces quatre diastéréoisomères, il y a deux paires d'énantiomères (2S,5R et 2R,5S, puis 2S,5S et 2R,5R) où les chiralités des deux centres stéréogènes ont leurs configurations inversées. En général, n centres d'asymétrie donneront 2n diastéréomères, dont 2n-1 paires d'énantiomères.