Chimie - Définition
La liste des auteurs de cet article est disponible ici.
Concepts de base
Élément
Un élément est une entité immatérielle dénuée de propriétés physiques ou chimiques. C'est un couple formé d'un symbole et d'un numéro atomique (numéro d'ordre dans le tableau périodique des éléments) qui caractérise les atomes, molécules, ions, nucléides isotopes d'une espèce chimique donnée. Il existe 92 éléments naturels et 17 artificiels connus. Un élément chimique désigne abstraitement l'ensemble des atomes qui ont un nombre donné de protons dans leur noyau. Ce nombre est son numéro atomique. Par exemple, tous les atomes avec 6 protons dans leurs noyaux sont des atomes de l'élément carbone C. Ces éléments sont rassemblés et ordonnés dans le tableau périodique.
Atome
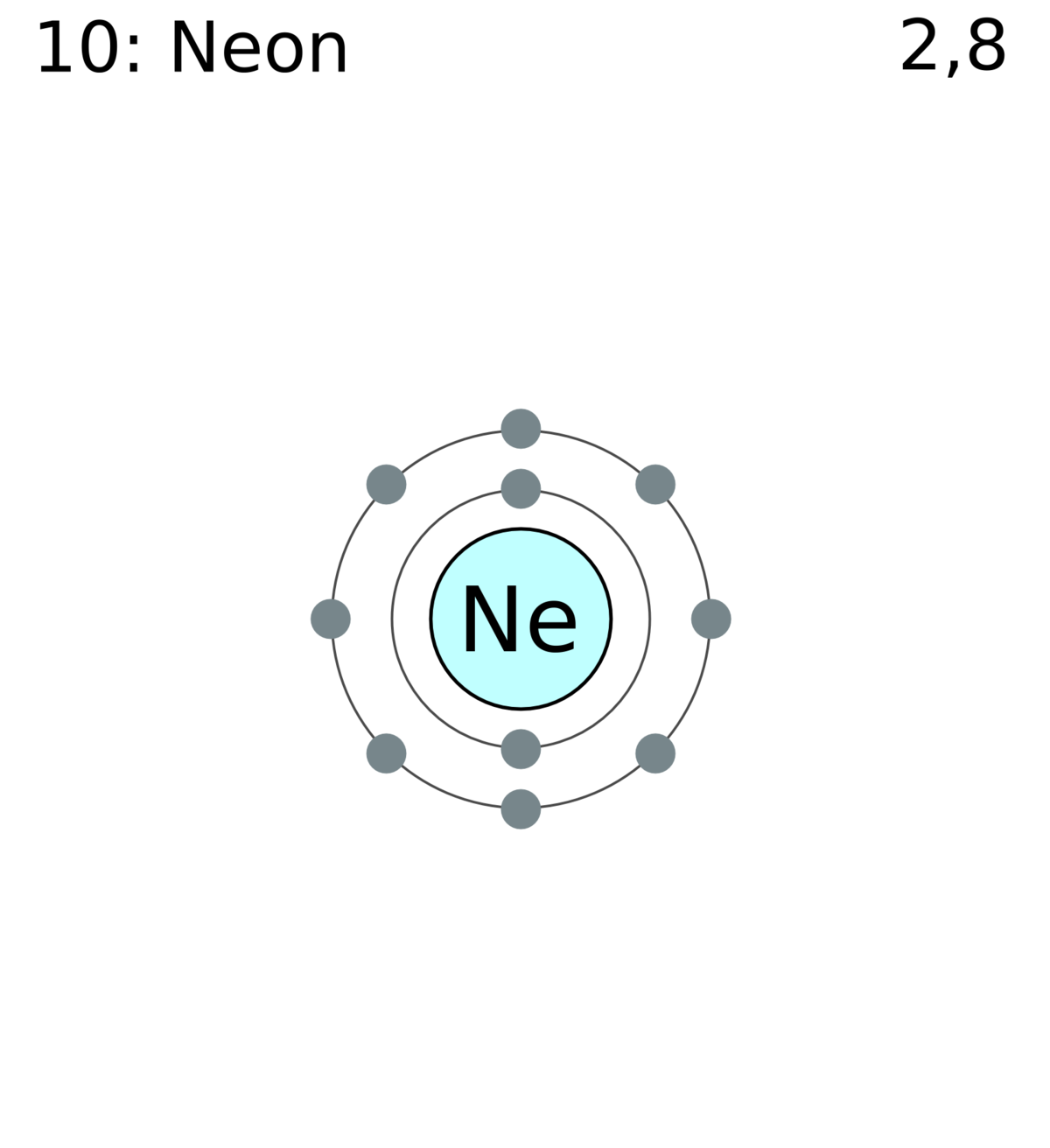
L'atome d'une espèce chimique est une entité matérielle. Il est formé d'un noyau atomique contenant des nucléons, en particulier d'un nombre Z de charge électrique élémentaire positive du noyau qui maintient autour de lui un nombre d'électrons, charge négatives équilibrant la charge positive du noyau. Il possède un rayon, une structure géométrique, ainsi que des propriétés chimiques et physico-chimiques spécifiques relevant de ce cortège électronique.
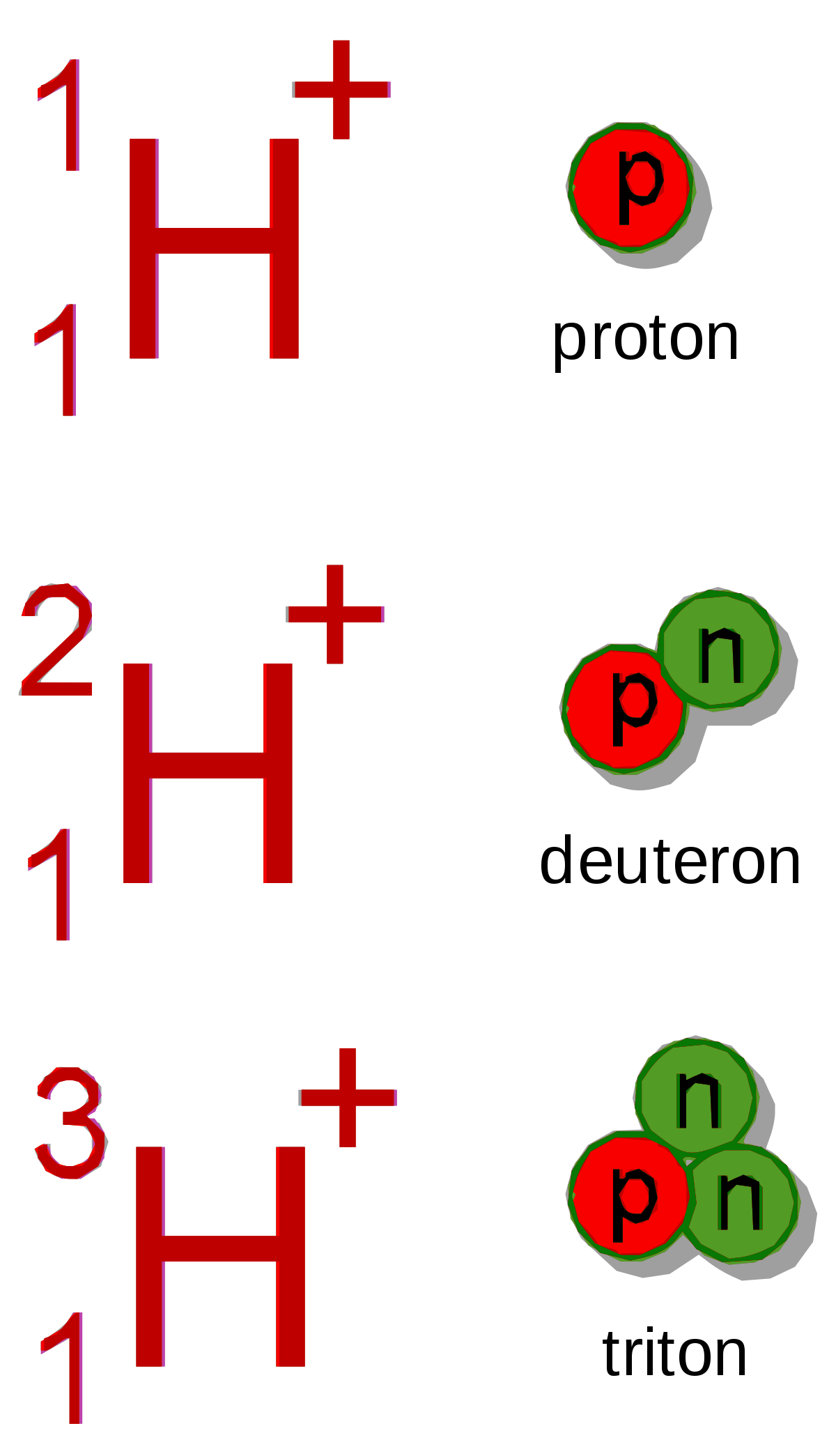
Isotope
Un isotope d'une espèce atomique est une entité matérielle caractérisée par :
- le symbole de son élément, le nombre Z qui est aussi le numéro atomique,
- le nombre de masse A qui représente la masse relative de l'isotope, A = Z + N.
Un isotope possède des propriétés nucléaires spécifiques. Les propriétés chimiques des divers isotopes ne diffèrent pas entre elles pour les atomes suffisamment lourds.
Molécule
Une molécule est un assemblage précis d'atomes, domaine défini et structuré dans l'espace et le temps par des liaisons chimiques fortes. Une molécule polyatomique se comporte essentiellement comme une entité aux propriétés propres, une individualité chimique radicalement différente des atomes qui composent son architecture. Si les molécules monoatomiques ou les petites molécules polyatomiques sont électriquement neutres, les molécules plus grandes ou complexes n'obéissent pas systématiquement à ce critère.
Mole
Le nombre de molécules participant à une réaction chimique est très élevé : il est dès l'emploi de quelques dizaines de grammes de matière proche du nombre d'Avogadro, donc de l'ordre de 6,02 1023.
Les chimistes utilisent communément une unité numérique, la mole. Une mole d'une entité chimique moléculaire précise implique mathématiquement l'égalité du nombre de ses molécules identiques au nombre d'Avogadro. Ce dernier nombre est défini par convention comme le nombre d'atome de carbone présents dans 12 grammes de carbone 12.
Une mole de gaz parfait occupe dans les conditions normalisées de pression et de température 22,4 litres. L'estimation de la masse molaire M d'un corps pur est facile en connaissant sa formule chimique. Une mole de ce corps pur désigne simplement le nombre d'Avogadro de molécules identiques de ce corps pur.
Liaison chimique
La liaison chimique impliquant la présence d'électrons liés à un ou plusieurs noyaux explique la réalité moléculaire. Plus précisément elle assure la stabilité des molécules et dans le cas d'un assemblage complexe la cohésion liante de chaque atome entre eux, mettant en jeu par échange ou partage un ou plusieurs électrons dans les liaisons covalentes, par mise en commun d'électrons collectifs à un vaste réseau d'atomes dans la liaison métallique ou initiant par de fortes dissymétries locales de charges, des forces électrostatiques.
Corps pur
Un corps pur est un corps généralement macroscopique constitué au niveau moléculaire d'une seule espèce chimique. Sa composition chimique, son organisation sous forme de gaz, liquide, solide amorphe ou réseaux cristallins...et ses propriétés physiques, par exemple les constantes physiques correspondant aux transitions de premier ordre comme la température de fusion, d'ébullition... peuvent être définies. En particulier, l'analyse chimique distingue les corps simples, dont l'espèce chimique est constituée d'atomes de mêmes éléments, des corps composés, dont l'espèce chimique est constituée d'atomes d'éléments différents.
Composé chimique
Un composé chimique désigne l'espèce chimique d'un corps composé. Un corps pur est caractérisé par sa formule chimique, écriture symbolique qui peut être plus ou moins complexe et détaillée, de sa composition chimique. La masse molaire d'un corps pur correspond au nombre d'Avogadro de son espèce chimique ou simple molécule.
Réaction chimique
Une réaction chimique est la transformation d’une ou de plusieurs espèces chimiques en d'autres espèces chimiques. Elle implique l'apparition ou la disparition d'au moins une liaison chimique. La réaction qui possède des caractéristiques thermiques nécessite ou fait apparaître différentes formes d’énergie en rapport avec l'énergie de liaison chimique.
Ion
Un ion est un atome qui a perdu ou gagné un ou plusieurs électrons. C'est un cation simple lorsque son cortège électronique a été privé d'un ou plusieurs électrons, il est chargé positivement. C'est un anion simple lorsque son cortège électronique est excédentaire, il est chargé négativement. Les anions ou cations formés à partir de molécules polyatomiques sont appelés ions complexes.
Complexe
Les complexes sont des édifices formés par un élément central et des ligands. L'élément central est souvent un ion métallique et le complexe peut être chargé. Ils ont une grande importance en chimie des solutions et en catalyse.
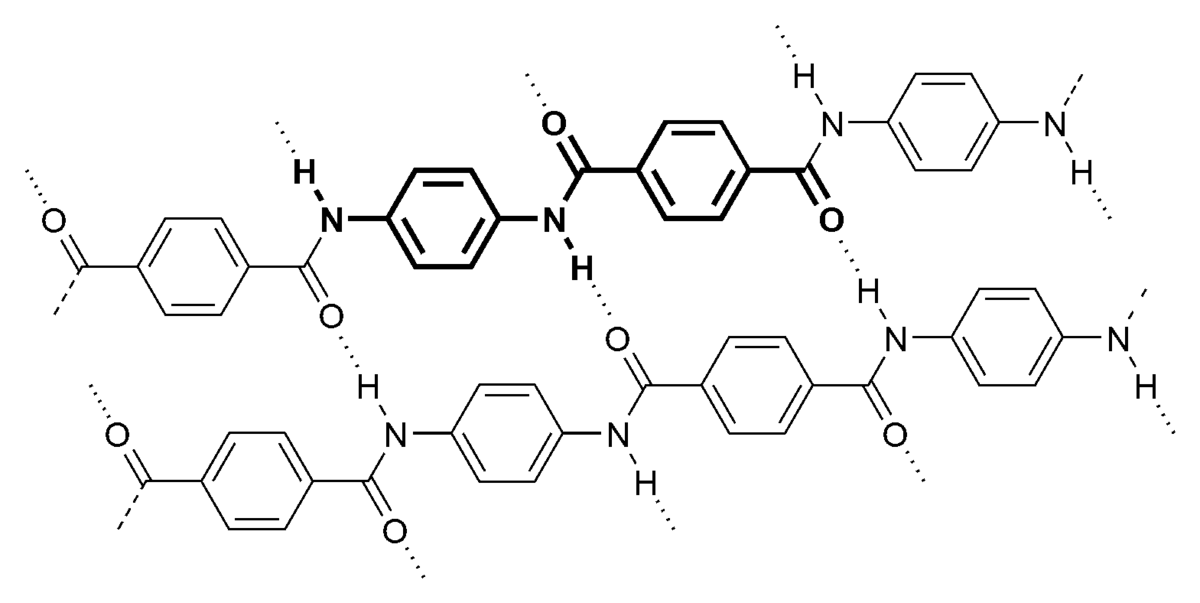
Polymères
Les polymères sont des grandes molécules ou macromolécules dont un grand nombre des plus communs est formé par la réaction en chaine de petites molécules appelées monomères. Ces polymères de synthèse industriels, dont la structure est fondée sur la réplication d'un motif organique de base peuvent être linéaires, ramifiés ou greffés, en réseau ou interpénétrés... Dans le cas de polymères formés par polyaddition de monomères organiques dont le site réactif est justement la double liaison carbone-carbone, le grand squelette plus ou moins souple formé d'atomes de carbone qui est décrit par ses configurations et longueur(s) de chaine moyenne(s) influence les propriétés observées. Citons parmi ces polymères organiques, les polyéthylènes, les polypropylènes, les polystyrènes, les polyisoprènes, les polybutadiènes, les PVC, les polyacryliques... Il existe d'autres sortes de réactions de polymérisations, comme les polycondensations à l'origine des polyesters, polyamides, polycarbonates, polyuréthanes. Il existe aussi des polymères à motifs minéraux, comme les silicones ou les polysufures.
Comme le pionnier Hermann Staudinger le pressentait en 1910, il existe des macromolécules ou polymères naturels, par exemple à base-motif de glucose ou sucre chimique comme la cellulose ou l'amidon, à base-motif d'acides aminés comme les protéines et ADN. La chimie macromoléculaire née dans les années trente a été un domaine continument innovateur, même au cours des dernières décennies.
Solution et émulsion
Une solution est un mélange homogène formé par un solvant en proportion majoritaire et d'un ou plusieurs solutés dans une phase homogène. La solubilité est la capacité d'un corps à entrer en solution dans un milieu donné. Par exemple un sel cristallin comme le chlorure de sodium NaCl ou sel de cuisine possède une limite de solubilité dans l'eau : 357 g/kg d'eau à 0°C et 391 à 100°C. Cela signifie qu'à partir de cette teneur limite, il y a séparation de phase parce que le sel précipite ou se dépose sous forme solide.
La miscibilité est la capacité d'un corps de se mélanger avec un autre en formant une seule phase. Le gaz ammoniac NH3 se mélange facilement à température ambiante avec l'eau liquide formant l'ammoniaque, 1 kg d'eau froide saturée d'ammoniac peut contenir 899 g de NH3. Les gaz principaux de l'air oxygène et azote sont aussi miscibles en certaines proportions dans l'eau liquide. 100 g d'eau liquide à 0°C peut contenir au maximum 4,89 cm³ du premier en solution et 2,3 cm³ du second.
Une émulsion est une dispersion d'une phase liquide à l'état de gouttelettes microscopiques ou submicroscopiques, dans une autre phase liquide non miscible. Une suspension est une dispersion d'une phase solide finement divisée au sein d'une autre phase liquide englobante. Pour qu'une suspension ou une émulsion soit stable, il faut que les fines gouttelettes ou les grains en suspension soient stabilisées par des molécules amphiphiles qui se placent à l'interphase, et ainsi il n'y a ni coalescence des gouttelettes ni agglomérations de particules solides. Mais il faut noter, avec le rigoureux chimiste et gastronome moléculaire, Hervé This, que l'immense majorité des systèmes culinaires ne sont pas des émulsions : ce ne sont que des dispersions colloïdales plus ou moins complexes.
L'art, à l'origine souvent empirique, de fabriquer des dispersions colloïdales a fourni des applications en pharmaceutique comme en cuisine, par exemple pour la préparation de chocolats et glaces, de sauces ou de mayonnaises.
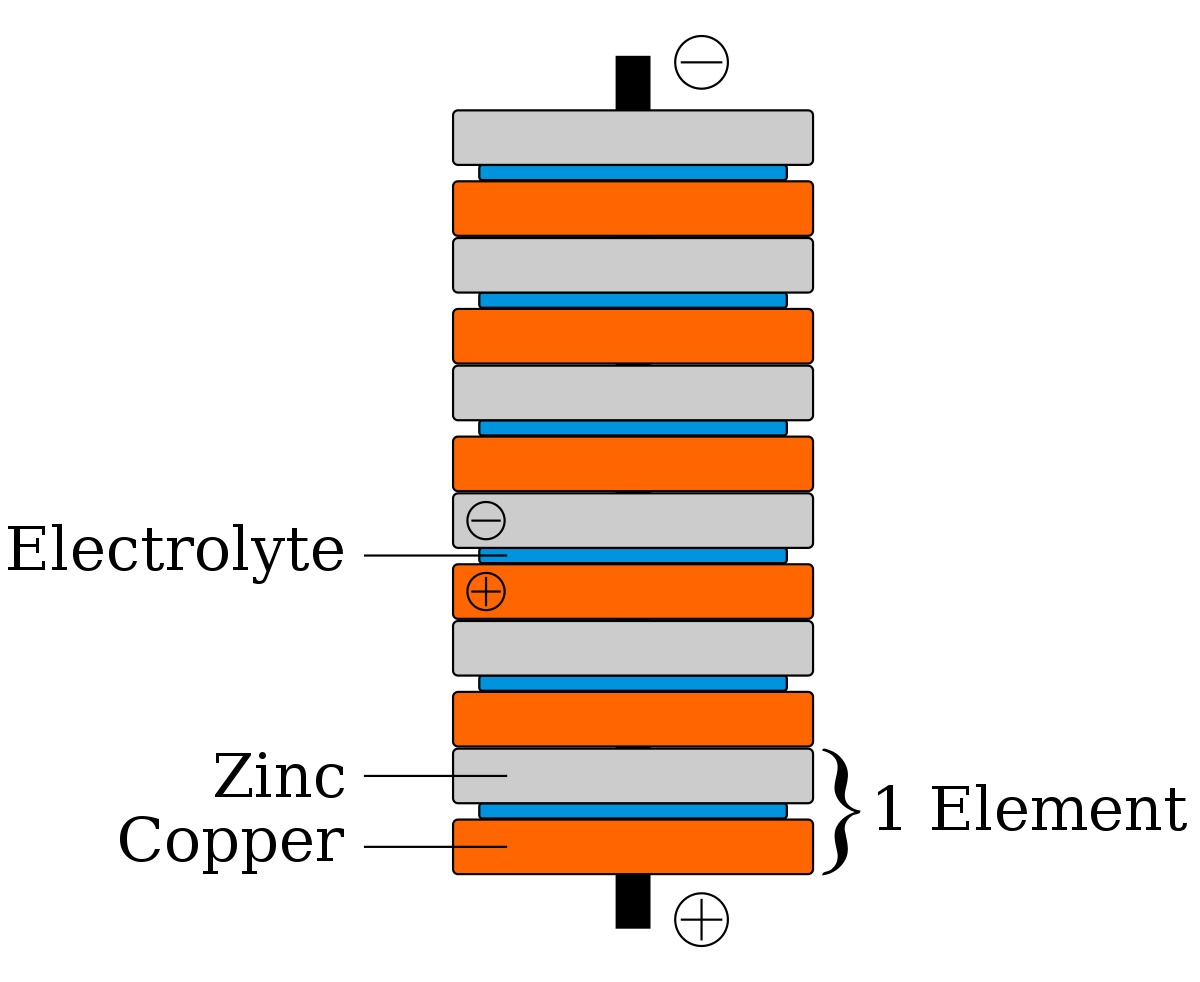
Oxydo-réduction et électrochimie
Une réaction d'oxydo-réduction met en jeu une perte ou un gain d’électron entre différents couples d'espèces chimiques. Une espèce d'un corps chimique ayant la capacité d’arracher des électrons à d’autres corps chimiques est appelée oxydant. De la même façon, une espèce d'un corps chimique capable de donner des électrons à une autre est appelée réducteur.
Acide et bases

Les réactions acides-bases en solution sont basées aussi sur des couples d'espèces chimiques. L' acidité et la basicité peuvent être calculées ou mesurées par la concentration des espèces chimiques en solution, qui prennent une forme acide ou base. Svante Arrhenius a mis en évidence dans les solutions aqueuses l'échange de protons entre les composés chimiques, la concentration en ion hydronium indique l'acidité du milieu comme la concentration en ion hydroxyle la basicité. Une extension de la modalité de classification à d'autres milieux solvants a été conduite par le chimiste américain Gilbert Newton Lewis .
Lois chimiques

La chimie, science expérimentale et descriptive, prenant un essor remarquable à l'époque industrielle tout en acceptant la modélisation physique et le langage mathématique là ils étaient pertinents, a découvert ou ouvert la voie à nombreuses lois physico-chimiques, parmi lesquelles :
- Lois de structure :
- Règles de l'octet, de Hund, de Klechkowski et de Pauli qui avec d'autres règles sur la stabilité du nuage électronique permettent de prévoir la configuration électronique des atomes.
- Théorie VSEPR ou Valence Shell Electronic Pairs Repulsion qui permet de prévoir la géométrie des molécules.
- Lois de cinétique et de thermodynamique
- Loi d'Arrhenius qui relie la constante de vitesse d'une réaction à l'énergie d'activation et à la température.
- Loi de Hess qui permet de déterminer les enthalpies de réaction à partir des enthalpies standards de formation.
- Loi de Henry et loi de Raoult qui permettent de déterminer la solubilité d'un gaz dans un liquide ou la pression de vapeur d'une solution idéale.
- Loi de Guldberg et Waage qui permet de définir l'équilibre thermodynamique d'un système réactionnel.
- Loi expérimentale de Van't Hoff qui permet de prévoir le sens d'un déplacement d'équilibre en fonction de la température.
- Lois de conservation
- Principe de conservation de la masse illustré par la célèbre phrase d'Antoine Lavoisier: « Rien ne se perd, rien ne se crée, tout se transforme. »
- Loi de Soddy qui illustre la conservation du nombre de charge.
- Lois de spectroscopie
- Loi de Beer-Lambert qui relie l'absorbance d'un élément en solution à sa concentration.
- Loi de Kasha qui décrit dans le modèle quantique la phosphorescence et la fluorescence.
- Lois d'électrochimie
- Lois de chimie organique
- Règle de Markovnikov et de Zaïtsev qui permettent de prévoir la régiosélectivité d'un réaction.