Chimie des gaz nobles - Définition
La liste des auteurs de cet article est disponible ici.
Premières structures connues contenant des gaz nobles
Jusqu'en 1962, les seuls « composés » de gaz nobles connus étaient des clathrates et des hydrates. Des composés de coordination avaient également été observés, mais uniquement par spectroscopie, sans être isolés.
- Clathrates
Ces structures ne sont pas de véritables composés chimiques de gaz nobles. Elles surviennent lorsqu'un atome est piégé dans le réseau d'un cristal ou dans certaines molécules organiques. Les atomes les plus lourds tels que le xénon, le krypton et l'argon peuvent former des clathrates avec le β-quinol, mais le néon et l'hélium sont trop petits pour être piégés.
Les clathrates de 85Kr constituent une source de particules β tandis que ceux de 133Xe sont utilisés comme sources de rayons γ.
- Composés de coordination
Leur observation effective n'a jamais été réellement attestée. L'observation du complexe d'argon et de trifluorure de bore (Ar•BF3), réputé exister à basse température, n'a jamais été confirmée, et les complexes de l'hélium avec le tungstène WHe2 et le mercure HgHe10 qui ont été observés après bombardement électronique de ces métaux, seraient en fait le résultat de l'adsorption de l'hélium sur la surface de ces métaux.
- Hydrates
La réalité des hydrates de gaz nobles est toujours débattue. La molécule d'eau étant fortement dipolaire, elle devrait induire un dipôle dans les atomes des gaz nobles, les plus lourds d'entre eux étant les plus sensibles à cet effet. Ce dipôle conduirait à la formation d'hydrates stables à pression élevée ; le plus stable serait l'hexahydrate de xénon Xe•6H2O.
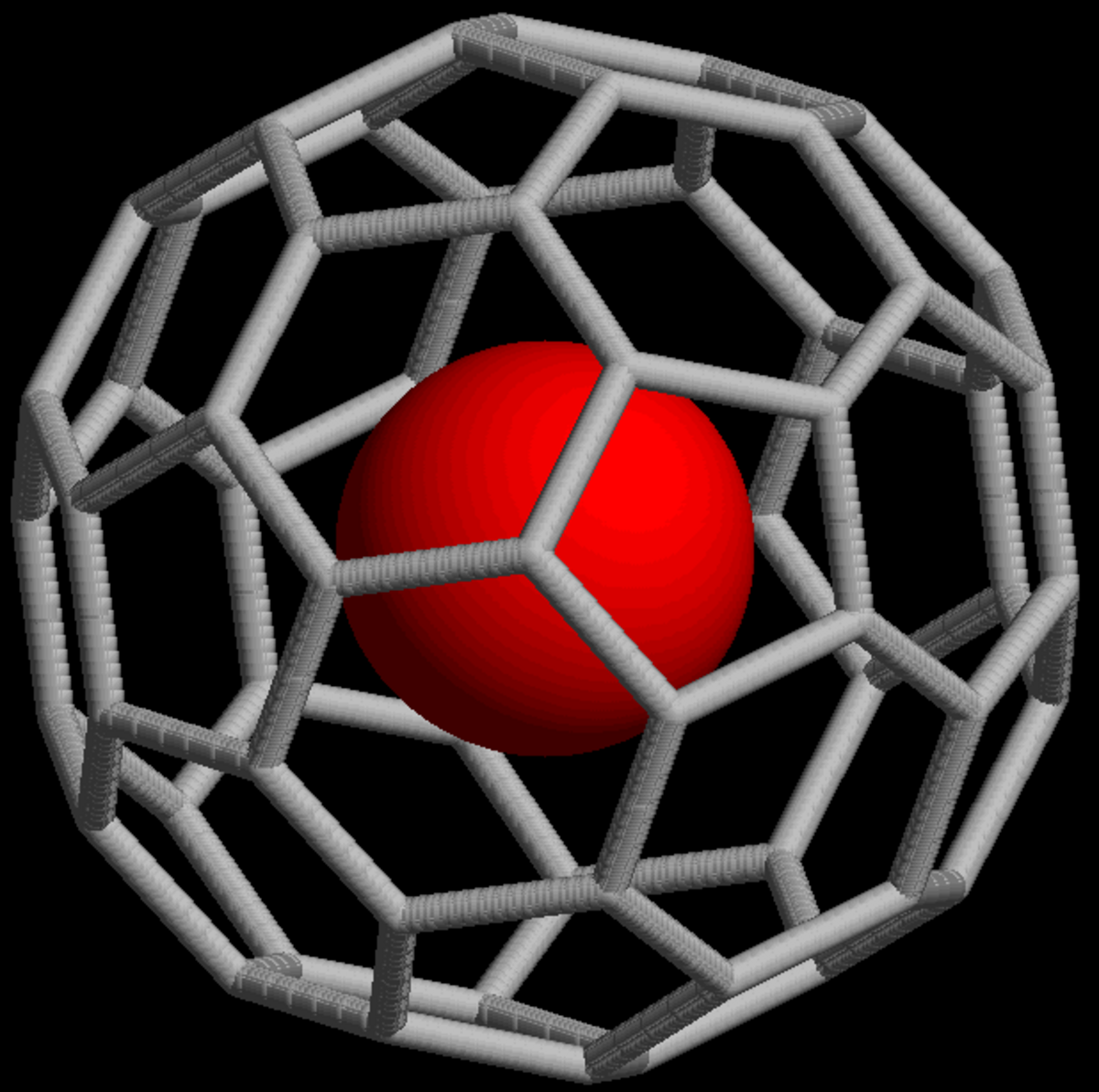
Complexes endoédriques de fullerènes
C'est l'une des formes de clathrates organiques de gaz nobles les plus étudiées ces dernières années. Les fullerènes forment une classe de molécules de carbone de forme sphéroïdale, ellipsoïdale, tubulaire (on parle alors de nanotubes) voire d'anneau. Le plus courant de ces fullerènes est composé de soixante atomes de carbone disposés aux sommet d'un icosaèdre tronqué donnant à la molécule l'aspect d'une sphère creuse évoquant un ballon de football. Ces molécules étant creuses, il est possible d'y piéger un atome de gaz noble quelconque, noté Ng, pour former un complexe, doté de propriétés physicochimiques particulières, qu'on note conventionnellement Ng@C60 (voir image ci-contre).
La formation de complexes He@C60 et Ne@C60 par application d'une pression de 300 kPa de d'hélium ou de néon sur du fullerène C60 a été publiée dès 1993. Mais en fait à peine une molécule de fullerène sur 650 000 peut être ainsi dopée par un atome endoédrique de gaz noble ; ce taux peut être porté à une molécule sur 1 000 en appliquant une pression de 300 MPa d'hélium ou de néon.
On a également obtenu des complexes endoédriques d'argon Ar@C60, de krypton Kr@C60 et de xénon Ne@C60.
Revue des composés de gaz nobles connus à ce jour
Excimères et exciplexes
Si les atomes de gaz nobles sont chimiquement peu réactifs à l'état fondamental, ils peuvent en revanche former des complexes entre eux ou avec des halogènes lorsqu'ils sont excités. Ces complexes sont stables lorsqu'ils sont excités, mais se dissocient dès que les atomes retombent à leur état fondamental : c'est ce qu'on appelle un excimère lorsque les atomes du complexe sont homogènes, ou un exciplexe lorsque les atomes du complexe sont hétérogènes. La transition d'énergie entre états excités et état fondamental est à l'origine d'un rayonnement de longueur d'onde précise utilisé dans la réalisation de certains lasers. Les principales espèces sont les suivantes :
- Excimères de gaz nobles : Ar2*, Kr2*, Xe2*.
- Exciplexes d'halogènes et de gaz nobles : NeF*, ArF*, KrF*, XeF*, ArCl*, KrCl*, XeCl*, XeBr*.
Chimie de l'hélium
- Configuration électronique de l'hélium : 1s2.
Outre un certain nombre d'excimères avec le tungstène, le fluor, l'iode, le soufre et le phosphore, l'hélium soumis à un flux d'électrons (sous l'effet d'un bombardement, d'une décharge ou à l'aide d'un plasma) peut également former des composés (dont la réalité "chimique" est encore débattue) avec le mercure (HgHe10) et le tungstène (WHe2), ainsi que des ions moléculaires HeNe+, He2+, He22+, HeH+ (hydrure d'hélium) et HeD+ (deutérure d'hélium).
En théorie, d'autres composés seraient possibles, tel que le fluorohydrure d'hélium HHeF, qui serait analogue au fluorohydrure d'argon HArF détecté en 2000.
Certains calculs laissent penser que l'hélium pourrait former des oxydes ioniques stables. Les deux nouvelles espèces moléculaires prédites par ce modèle, CsFHeO et N(CH3)4FHeO, dériveraient de l'anion métastable OHeF- déjà proposé en 2005 par une équipe de Taïwan, dans lequel la liaison O-He serait de nature covalente et la charge négative portée essentiellement par l'atome de fluor. Néanmoins, ces propositions demeurent pour l'heure de simples spéculations.
Chimie du néon
- Configuration électronique du néon : 1s2 2s2 2p6.
Le néon est en principe le moins réactif de tous les gaz nobles, et on considère généralement qu'il est réellement inerte chimiquement. Les énergies de liaisons calculées pour le néon avec divers éléments (hydrogène, bore, béryllium, métaux nobles) sont encore inférieures à celles calculées pour l'hélium. Aucun composé neutre du néon n'a été identifié, en revanche les ions moléculaires HNe+, HeNe+, Ne2+ et NeAr+ ont été observés lors d'études optiques ou spectroscopiques.
Chimie de l'argon
- Configuration électronique de l'argon : 1s2 2s2 2p6 3s2 3p6.
L'argon est à peine plus réactif que le néon. Le seul composé connu à ce jour autour de l'argon est l'hydrofluorure d'argon HArF, synthétisé en août 2000 à l'Université d'Helsinki. Cette molécule n'a en fait jamais été isolée, mais seulement détectée par spectroscopie. Elle est extrêmement instable, et se dissocie en argon et fluorure d'hydrogène au-dessus de -246 °C.
Chimie du krypton
- Configuration électronique du krypton : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
Le krypton est le plus léger des gaz nobles pour lequel on a pu isoler au moins un composé covalent, en l'occurrence le difluorure de krypton KrF2, synthétisé pour la première fois en 1963 dans la foulée des travaux sur le xénon. D'autres composés, dans lesquels un atome de krypton est lié à un atome d'azote pour les uns et à un atome d'oxygène pour les autres, ont également été publiés, mais ils ne sont stable qu'en dessous de -60 °C pour les premiers et -90 °C pour les seconds. Certains résultats font ainsi état de la synthèse de divers oxydes et fluorures de krypton, ainsi que d'un sel d'oxoacide de krypton (à l'instar de la chimie du xénon).
Des études sur les ions moléculaires ArKr+ et KrH+ ont eu lieu, et les espèces KrXe et KrXe+ ont été observées.
Les équipes de l'Université d'Helsinki, à l'origine de la détection du fluorohydrure d'argon HArF, auraient également détecté du cyanohydrure de krypton HKrC≡N ainsi que de l'hydrokryptoacétylène HKrC≡CH, qui se dissocieraient dès 40 K.
D'une manière générale, il faut recourir à des conditions extrêmes (matrice cryogénique ou jet gazeux supersonique) pour observer des molécules neutres dans lesquelles un atome de krypton est lié à un non-métal comme l'hydrogène, le carbone ou le chlore, voire à un métal de transition tel que le cuivre, l'argent ou l'or.
Chimie du xénon
- Configuration électronique du xénon : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6.
L'hexafluoroplatinate de xénon a été le premier composé jamais synthétisé du xénon (et, plus généralement, d'un gaz noble : voir plus haut).
À la suite de ces travaux, fondés sur des réactions d'oxydation, une foule de composés de xénon combiné à du fluor et/ou de l'oxygène ont été réalisés, donnant une série d'oxydes, de fluorures et d'oxyfluorures de xénon :
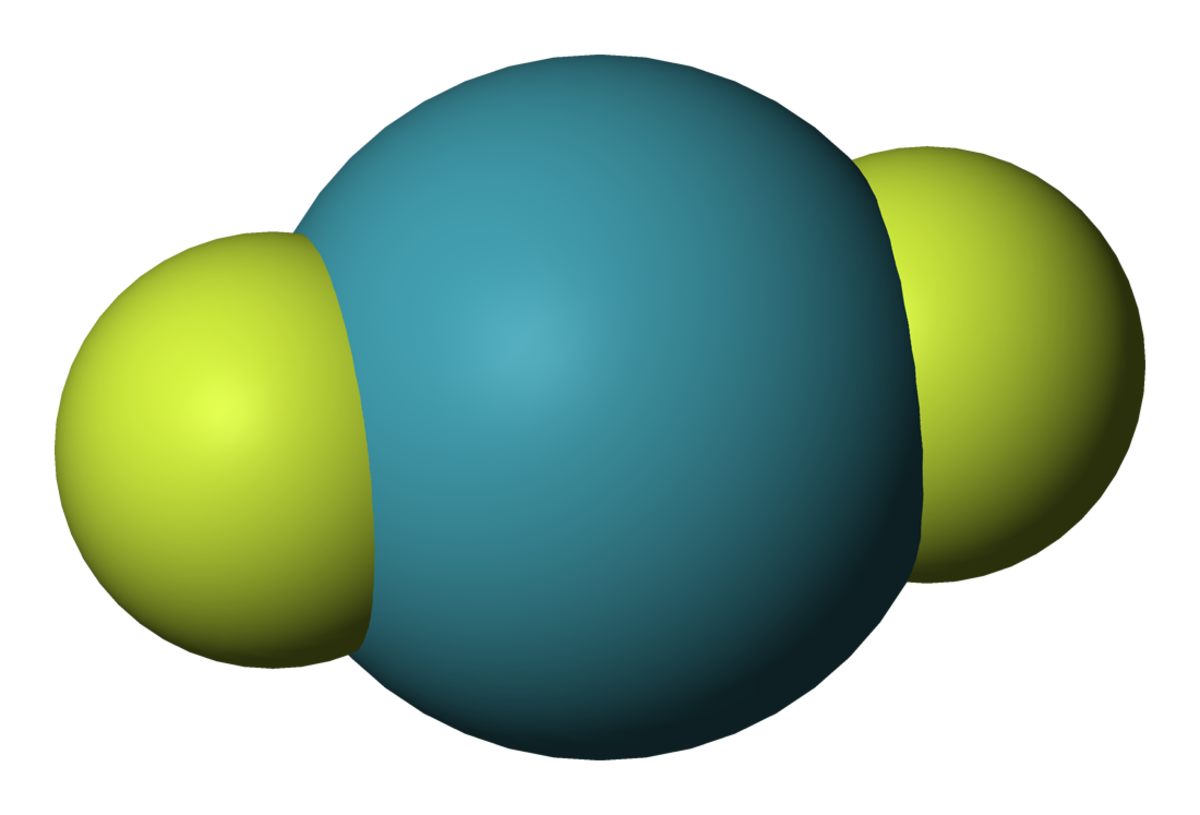
- XeF2 : Difluorure de xénon
- XeF4 : Tétrafluorure de xénon
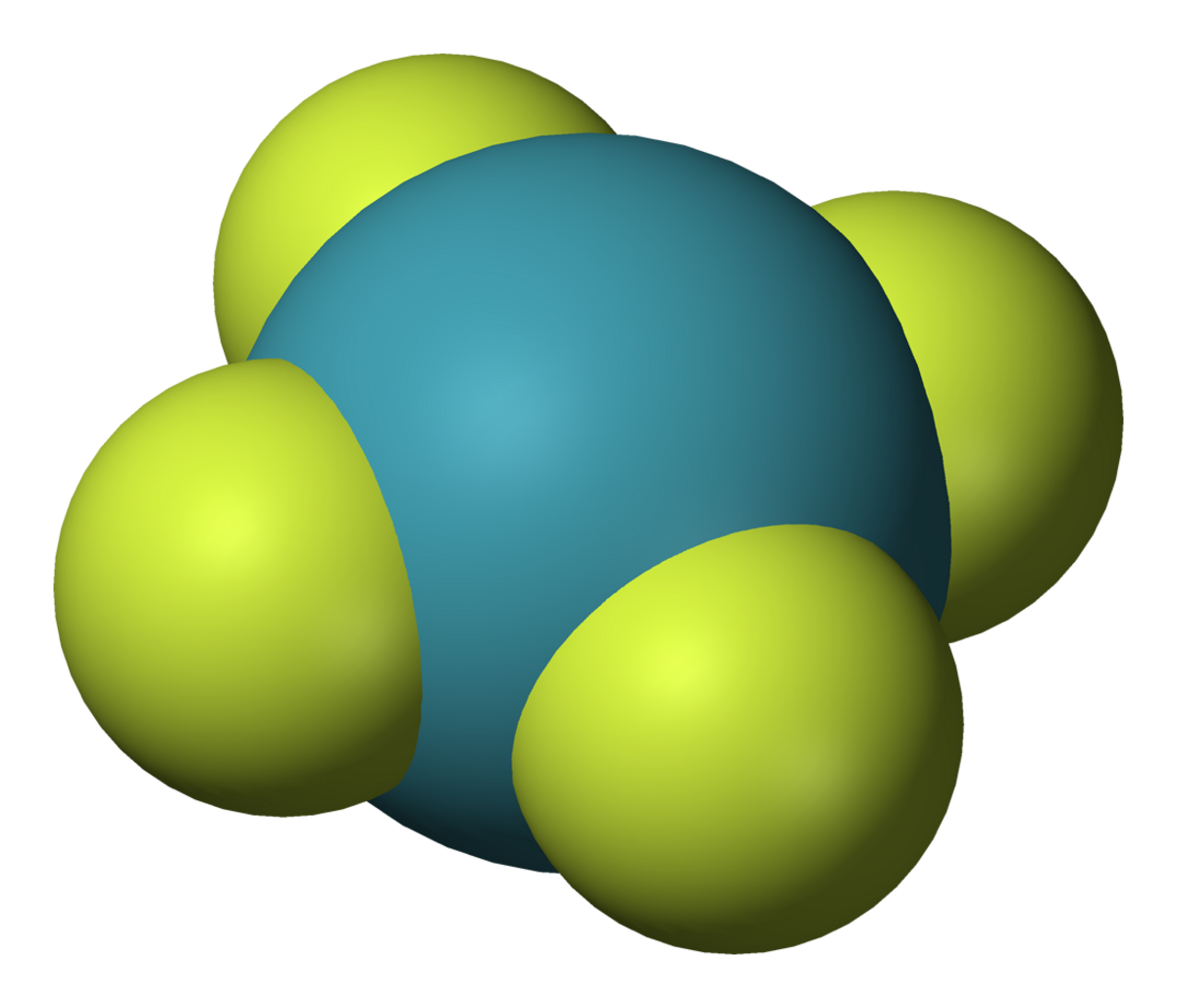
- XeF6 : Hexafluorure de xénon
- XeO3 : Trioxyde de xénon, un solide explosif
- XeO4 : Tétraoxyde de xénon
- XeOF2 : Oxydifluorure de xénon
- XeO2F2 : Dioxydifluorure de xénon
- XeO3F2 : Trioxydifluorure de xénon
- XeOF4 : Oxytétrafluorure de xénon
- XeO2F4 : Dioxytétrafluorure de xénon
Les oxydes de xénon sont solubles dans l'eau, où ils donnent deux oxoacides :
- H2XeO4 : acide xénique, solution aqueuse de XeO3
- H4XeO6 : acide perxénique, solution aqueuse de XeO4
L'acide perxénique est lui-même susceptible de former des perxénates, par exemple :
- Na4XeO6 : Perxénate de sodium, soluble dans l'eau
- K4XeO6 : Perxénate de potassium, soluble dans l'eau
- Ba2XeO6 : Perxénate de baryum, insoluble
Le dioxyde de xénon XeO2 demeure rebelle à toute tentative de synthèse, et seul le cation XeO2+ a été détecté par spectroscopie dans de l'argon congelé.
La grande majorité des composés du xénon produits jusque dans les années 1980 combinaient le fluor et/ou l'oxygène avec le xénon; lorsqu'ils intégraient d'autres éléments, comme de l'hydrogène ou du carbone, c'étaient généralement avec des atomes électronégatifs d'oxygène et/ou de fluor. Néanmoins, une équipe animée par le Prof. Markku Räsänen de l'Université d'Helsinki a publié en 1995 la synthèse du dihydrure de xénon XeH2, puis celle de l'hydroxy-hydrure de xénon HXeOH, de l'hydroxénoacétylène HXeCCH et d'autres composés du xénon. Par la suite, Khriatchev et al. ont publié la synthèse de HXeOXeH par photolyse d'eau dans une matrice de xénon congelé. Ils ont également fait état des molécules deutérées HXeOD et DXeOD. Le nombre de composés connus du xénon est aujourd'hui de l'ordre du millier, certains présentant des liaisons entre le xénon et le carbone, l'azote, le chlore, l'or ou le mercure, tandis que d'autres, observés dans des conditions extrêmes (matrices cryogéniques ou jets gazeux supersoniques) présentent des liaisons entre le xénon et l'hydrogène, le bore, le béryllium, le soufre, l'iode, le brome, le titane, le cuivre et l'argent.
L'un des composés les plus inattendus du xénon est le complexe qu'il forme avec l'or. Le cation tétraxénon-or AuXe42+ a en effet été caractérisé par l'équipe allemande du Prof. Konrad Seppelt dans le complexe AuXe42+(Sb2F11−)2.
Les composés des gaz nobles sont vus comme des espèces hypercoordonnées dans la mesure où ils violent la règle de l'octet. Les liaisons dans ce type de structure peuvent être décrites selon le modèle de la liaison à trois centres et quatre électrons, dans lequel trois atomes colinéaires établissent deux liaisons résultant chacune de trois orbitales moléculaires issues des orbitales atomiques p de chacun des trois atomes. L'orbitale moléculaire haute occupée se concentre sur les ligands, configuration stabilisée par leur caractère électronégatif : typiquement l'oxygène et, surtout, le fluor.
Une liaison 3c-4e s'établit entre deux ligands situés de part et d'autre de l'atome de xénon. Les fluorures de xénon sont particulièrement bien décrits par ce modèle, qui explique d'une part pourquoi on a toujours un nombre pair d'atomes de fluor autour du xénon dans ces composés, et d'autre part pourquoi leur géométrie est toujours à base d'unités F-Xe-F orthogonales :
|
| |
| Difluorure de xénon XeF2 | Tétrafluorure de xénon XeF4 | Hexafluorure de xénon XeF6 |
|---|
Chaque unité F-Xe-F formant une liaison 3c-4e peut également être vue comme en équilibre entre deux formes ioniques en résonance :
- F-Xe+ -F
Cette représentation avec les formules de Lewis rend également bien compte de l'accroissement de la densité électronique autour des atomes de fluor ainsi que de la géométrie de ces molécules.
Chimie du radon
- Configuration électronique du radon : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6.
Le radon est un gaz noble radioactif. Son isotope le plus stable, le 222Rn, est issu du 226Ra et se désintègre par radioactivité α en 218Po avec une période radioactive de 3,823 jours. Cette donnée limite fortement les recherches pratiques sur cet élément ainsi que les retombées potentielles de ces recherches, d'autant que ce gaz noble est plutôt cher. C'est la raison pour laquelle, bien que le radon soit chimiquement plus réactif que le xénon, assez peu de composés de radon ont à ce jour été publiés ; ce sont simplement des oxydes ou des fluorures.
Le fluorure de radon a ainsi été synthétisé dans les années 1970; c'est un solide faiblement volatil dont la composition exacte n'a jamais pu être établie en raison de la radioactivité du radon. Il pourrait s'agir d'un composé ionique plus que covalent. La modélisation de la structure du difluorure de radon RnF2 aboutit à une longueur de 208 pm pour la liaison Rn-F, et une stabilité thermodynamique supérieure pour RnF2 que pour XeF2. La molécule octaédrique d'hexafluorure de radon RnF6 aurait une enthalpie de formation encore plus faible que celle de RnF2.
L'ion RnF+ se formerait avec l'hexafluoroarsénate de dioxygényle O2SbF6 selon la réaction:
- Rn(g) + 2 O2+SbF6-(s) → RnF+Sb2F11-(s) + 2 O2 (g)
Des oxydes de radon auraient également été synthétisés, notamment le trioxyde de radon RnO3 en URSS. Le carbonyle de radon RnCO serait stable, avec une configuration linéaire. Les molécules Rn2 et XeRn seraient étroitement stabilisées par couplage de spin.
Chimie (théorique) de l'élément 118 (ununoctium)
- Configuration électronique supposée de l'ununoctium : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 ?
L'ununoctium est un élément synthétique radioactif de numéro atomique 118 et de symbole Uuo appartenant à la colonne des gaz nobles mais chimiquement très différents de ces derniers. Son noyau très instable n'a permis d'en synthétiser en tout et pour tout que trois atomes à ce jour, avec de surcroît une période radioactive de 0,89 ms (nucléide 294Uuo). Dans ces conditions, toutes nos connaissances sur les propriétés massives de cet élément sont issues de modèles théoriques élaborés pour certains dès les années 1960.
La structure électronique de l'élément 118 lui conférerait une réactivité chimique significative, qui le ferait s'écarter du paradigme des gaz nobles, avec un caractère électropositif plus marqué. Les calculs sur la molécule Uuo2 ont montré qu'elle aurait une énergie de liaison du même ordre de grandeur que celle du dimère de mercure Hg2 et une énergie de dissociation de 6 kJ/mol, soit quatre fois plus que celle du dimère Rn2. Mais le plus frappant est que la longueur de liaison calculée pour Uuo2 serait inférieure de 16 pm à celle de Rn2, signe d'une liaison assez forte. Néanmoins, l'ion UuoH+ aurait une énergie de dissociation inférieure à celle de l'ion RnH+. Le composé neutre UuoH aurait une liaison extrêmement faible, qui serait assimilable à une pure liaison de Van der Waals.
L'ununoctium semble former des composés plus stables avec les éléments très électronégatifs, notamment avec le fluor dans le difluorure d'ununoctium UuoF2 et le tétrafluorure d'ununoctium UuoF4.
Contrairement aux autres gaz nobles, l'élément 118 serait assez électropositif pour former des liaisons covalentes avec le chlore et conduire à des chlorures d'ununoctium UuoCln.