Cétone - Définition
La liste des auteurs de cet article est disponible ici.
Formation
On obtient les cétones avec une oxydation ménagée d'un alcool secondaire. Cela nécessite un fort agent oxydant. Cependant, ici, il n'y a pas de "risque" : une cétone après être formée ne peut plus être oxydée, contrairement à l'aldéhyde, qui peut encore l'être en acide carboxylique.
Oxydation industrielle
- oxydation par O2 de l'air
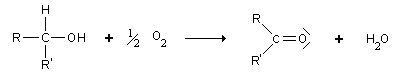
On peut utiliser comme catalyseur Fe2O3 ou MnO3 à 400 °C, ou un catalyseur à base d'argent vers 600 °C.
- Déshydrogénation catalytique des alcools secondaires
L'alcool est gazeux. On utilise comme catalyseur CuO vers 400 à 500 °C, Ag, Cu vers 300 °C, ZnO ou encore ZrO vers 300 à 400 °C.
- Procédé de Wacker-Hœchst
Oxydation chimique
On utilise souvent le dichromate de potassium, ou le Cr(VI) (via du PCC par exemple) , mais le réactif le plus couramment utilisé est le réactif de Jones : CrO3 en présence d'acide sulfurique dans l'acétone. Parfois, si la présence d'un acide est gênante, on utilise le réactif de Sarett : CrO3 dans la pyridine.
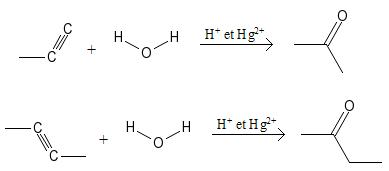
Hydrolyse des alcynes
En ajoutant de l'eau à un alcyne en milieu acide, un groupement carbonyle se formera sur le carbone porteur de la triple liaison ayant le moins d'hydrogènes (règle de Markovnikov), à condition d'avoir du mercure oxydé +2 comme catalyseur (Hg2+). L'autre carbone porteur de la triple liaison sera réduit en gagnant deux atomes d'hydrogène.
Par ozonolyse des alcènes
L'ozonolyse consiste à traiter un réactif à l'ozone et à l'eau. Ici, l'alcène subit une ozonolyse pour former un groupement carbonyle, à condition d'avoir comme catalyseur de l'acide éthanoïque (ou acide acétique) et du zinc oxydé +2 (Zn2+). Ceci forme un intermédiaire cyclique très instable : l'ozonide, qui se transforme ensuite en cétone ou en aldéhyde. Afin d'obtenir une cétone à partir d'un alcène, au moins un carbone porteur de la double liaison doit être exclusivement lié à d'autres carbones, faute de quoi, un aldéhyde sera formé. La réaction dégage également du peroxyde d'hydrogène.
Par exemple, en traitant le 2-méthylbut-2-ène à l'ozone et à l'eau (avec les catalyseurs nécessaires), on obtient la propanone (une cétone), l'éthanal ou l'acétaldéhyde (un aldéhyde) et le peroxyde d'hydrogène.
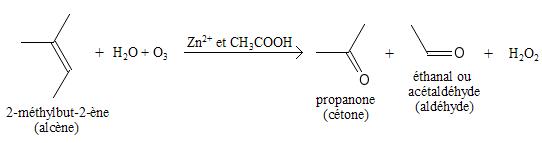
Par une réaction de Friedel-Craft sur un composé aromatique
Le principe consiste à mettre en présence un benzène avec un chlorure d'acyle et du AlCl3. Le résultat est une cétone fixée sur le benzène et du HCl. Le mécanisme de réaction suit le principe d'une addition électrophile sur un aromatique, d'où la présence d' AlCl3 (acide de Lewis) qui va servir à créer un électrophile (voir Réaction de Friedel-Crafts)
Tests de reconnaissance
- Additions de composés de type Z-NH2 (amines) : formation d'un précipité.
- Réaction haloforme : caractérise les cétones alpha-méthylées. En présence d'un halogène en milieu basique, il se forme un haloforme. Par exemple, avec l'iode et la propanone, on aurait un iodoforme (précipité jaune).
Mais ces méthodes utilisant des réactions chimiques avec la cétone, la détruisent. On utilise maintenant plus volontiers les méthodes de spectrométrie (RMN et infrarouge) permettent de détecter cette fonction sans destruction de l'échantillon.

















































