Céramique technique - Définition
La liste des auteurs de cet article est disponible ici.
Synthèse
Différentes méthodes existent, elles diffèrent de par le milieu « sec » ou « humide », les conditions expérimentales, la mise en forme souhaitée.
Méthodes par voie sèche
Méthode céramique conventionnelle
C'est une réaction en phase solide à haute température donc par voie sèche. Le but est d'obtenir à partir d'un mélange de composés solides en poudre, en proportion stœchiométriques, un nouveau produit par un traitement thermique approprié. Cette technique sert plutôt à la réalisation de pièces massives, minimum de l'ordre du millimètre en épaisseur.
- Réaction chimique : deux oxydes naturels sont broyés et mélangés à température élevée (~1200°C) mais en dessous de leur température de fusion, les poudres étant solides, la réaction se passe à la surface de contact entre particules.
- Frittage : processus physico-chimique par lequel la poudre de fines particules est densifiée en dessous de sa température de fusion en un matériau massif, résistant et plus ou moins compact. Le frittage est nécessaire parce que la température de fusion des céramiques est très haute (jusqu'à 2000°C), la mise en forme ne peut donc pas se faire par coulée ou moulage de matière fondue ; de plus leur déformation plastique est faible ce qui rend le forgeage et le laminage difficiles.
Cette synthèse nécessite plusieurs étapes techniques :
- Préparation des poudres : c'est un travail de diffusion et dispersion des poudres par mélangeage et broyage. Il permet d'améliorer la granulométrie et d'homogénéiser la poudre de départ.
- Mise en forme : processus servant à consolider les poudres. Suivant la mise en forme désirée et l'état, sec ou humide, du matériau il faut choisir entre plusieurs techniques de façonnage : pressage, extrusion, injection, coulage... Mises en formes détaillées plus bas.
- Traitement thermique : peut dans un premier temps conduire au déliantage, décarbonatation, élimination d'eau additionnelle si nécessaire. Il provoque des transformations physico-chimiques qui modifient la nature des phases en présence et la microstructure du matériau ce qui permet de densifier les poudres et obtenir la phase désirée. Le frittage est un phénomène particulier dû au traitement thermique.
- Finition : usinage, polissage, revêtement.
- Exemple 1 :
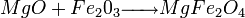
- Exemple 2 :
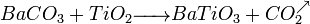
Ablation Laser
Ces techniques permettent la réalisation de couches très minces de l'ordre du nanomètre.
Méthodes par voie humide
Co-précipitation chimique en solution
Le travail de diffusion nécessaire est moindre que pour la méthode céramique les températures et les durées du traitement thermique sont donc plus faibles. De plus la taille et la morphologie des poudres formées peuvent être contrôlées. Ce sont des avantages certains sur la méthode solide conventionnelle. Ces techniques permettent la réalisation de couches minces de l'ordre du micromètre.
Co-précipitation d'hydroxydes
Cette technique consiste à faire co-précipiter des précurseurs en phase aqueuse, sels métalliques, par action d'une base. Les précipités sont de la forme : M1M2(OH)x,zH2O. L'eau est ensuite éliminée par traitement thermique.
- Exemple 1 : préparation du ferrite spinelle CoFe2O4 :
- Co-précipitation de chlorures métalliques par action de la soude :
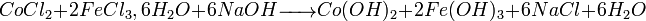
- Traitement thermique (700°C vs 1200°C pour la méthode céramique) :
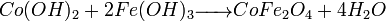
- Exemple 2 : préparation du ferrite spinelle mixte Ni0.5Zn0.5Fe2O4
- Co-précipitation de chlorures métalliques par action de la soude :
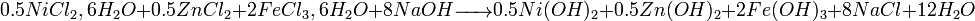
- Traitement thermique (700°C) :
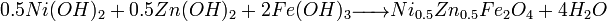
- Importance du pH : il faut se placer à un pH auquel les hydroxydes métalliques coéxistent, dans le cas présent pH de 9-10, sinon il n'y a pas précipitation.
Co-précipitation d'oxalates
Co-précipitation d'oxalates métalliques par action de l'acide oxalique. Les précipités sont de la forme : M1M2(C2O4)x,zH2O. L'eau et les oxalates sont ensuite éliminés par traitement thermique.
- Exemple :
- Co-précipitation de chlorures métalliques par action de l'acide oxalique :
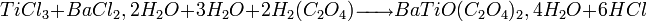
- Traitement thermique (700°C vs 1200°C pour la méthode céramique) :
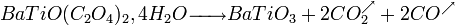
Méthode sol-gel
Le procédé sol-gel permet de fabriquer un polymère inorganique par des réactions chimiques simples et à une température proche de la température ambiante (20 à 150 °C). La synthèse est effectuée à partir d'alcoolates de formule M(OR)n où M est un métal ou le silicium et R un groupement organique alkyle CnH2n+1. Un des intérêts de ce procédé est que ces précurseurs existent pour un grand nombre de métaux et non-métaux. Ils sont soit liquides soit solides, dans ce cas ils sont, pour la plupart, solubles dans des solvants usuels. Il est donc possible de préparer des mélanges homogènes des monomères (précurseurs) ou oligomères. Les réactions chimiques simples à la base du procédé sont déclenchées lorsque les précurseurs sont mis en présence d’eau : l'hydrolyse des groupements alcoxyles intervient tout d’abord, puis la condensation des produits hydrolysés conduit à la gélification du système. Le procédé sol-gel permet de mettre le matériau final sous diverses formes, parmi lesquelles les monolithes (matériaux massifs de quelques mm³ à quelques dizaines de cm³) et les films minces (de quelques nanomètres à quelques dizaines de micromètres d'épaisseur).
- Exemple : Synthèse de SiO2 par procédé sol-gel.
- Hydrolyse :
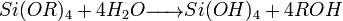
- Condensation :
- Par alcoxolation :
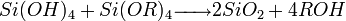
- Par oxolation :
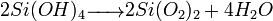
- Par alcoxolation :

















































