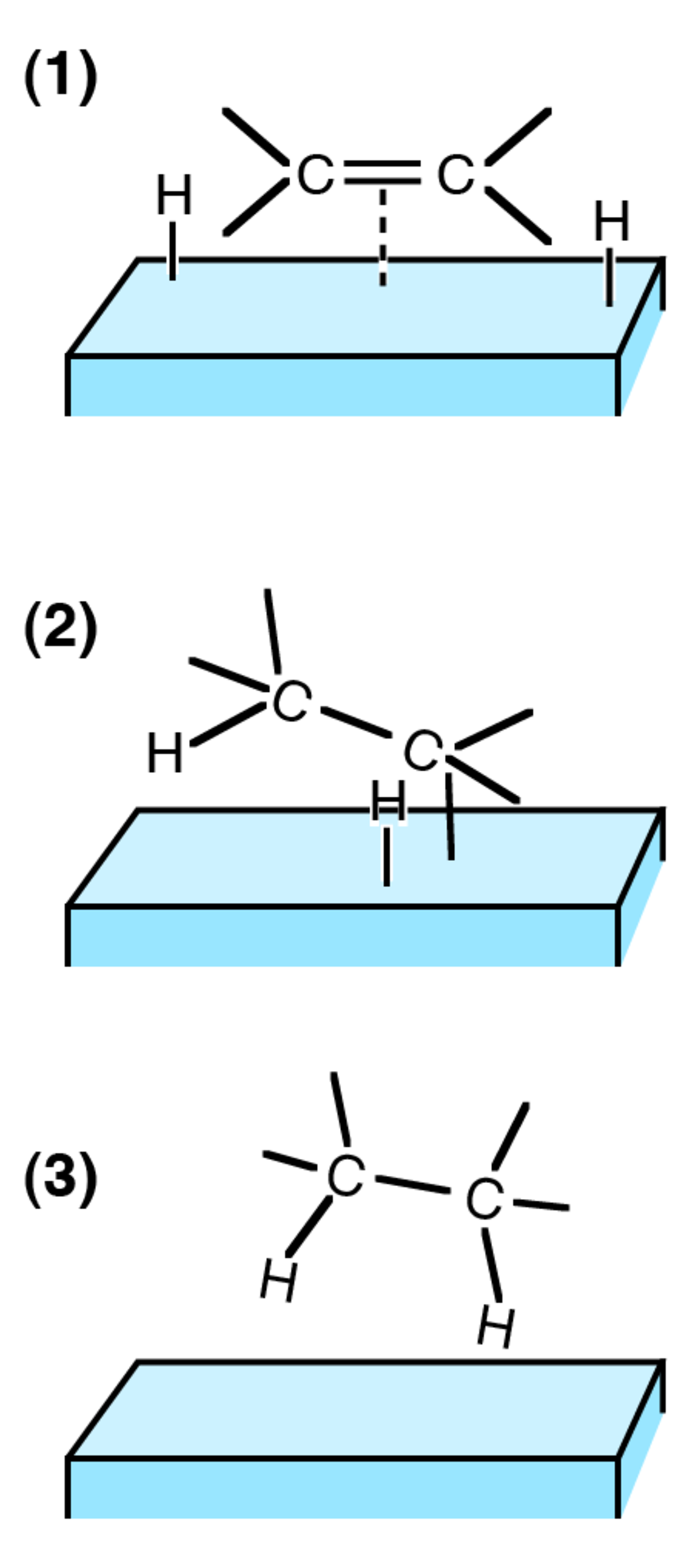
Catalyse - Définition
La liste des auteurs de cet article est disponible ici.
Considérations générales
Catalyseur
En chimie, un catalyseur est une substance qui augmente ou diminue la vitesse d'une réaction chimique ; il participe à la réaction mais est régénéré à la fin de la réaction. Il ne fait donc partie ni des réactifs ni des produits dans l'équation. Lorsqu’un catalyseur est utilisé pour accélérer une transformation, on dit que celle-ci est catalysée. Les catalyseurs agissent seulement sur des produits prédéterminés. Si un catalyseur accélère la réaction, il est dit positif; S'il la ralentit, il est dit négatif.
Les catalyseurs sont largement utilisés dans l'industrie et en laboratoire parce qu'ils augmentent considérablement la production des produits tout en minimisant les coûts de production. Dans la nature et en biochimie, certaines protéines possèdent une activité catalytique. Ils s'agit des enzymes.
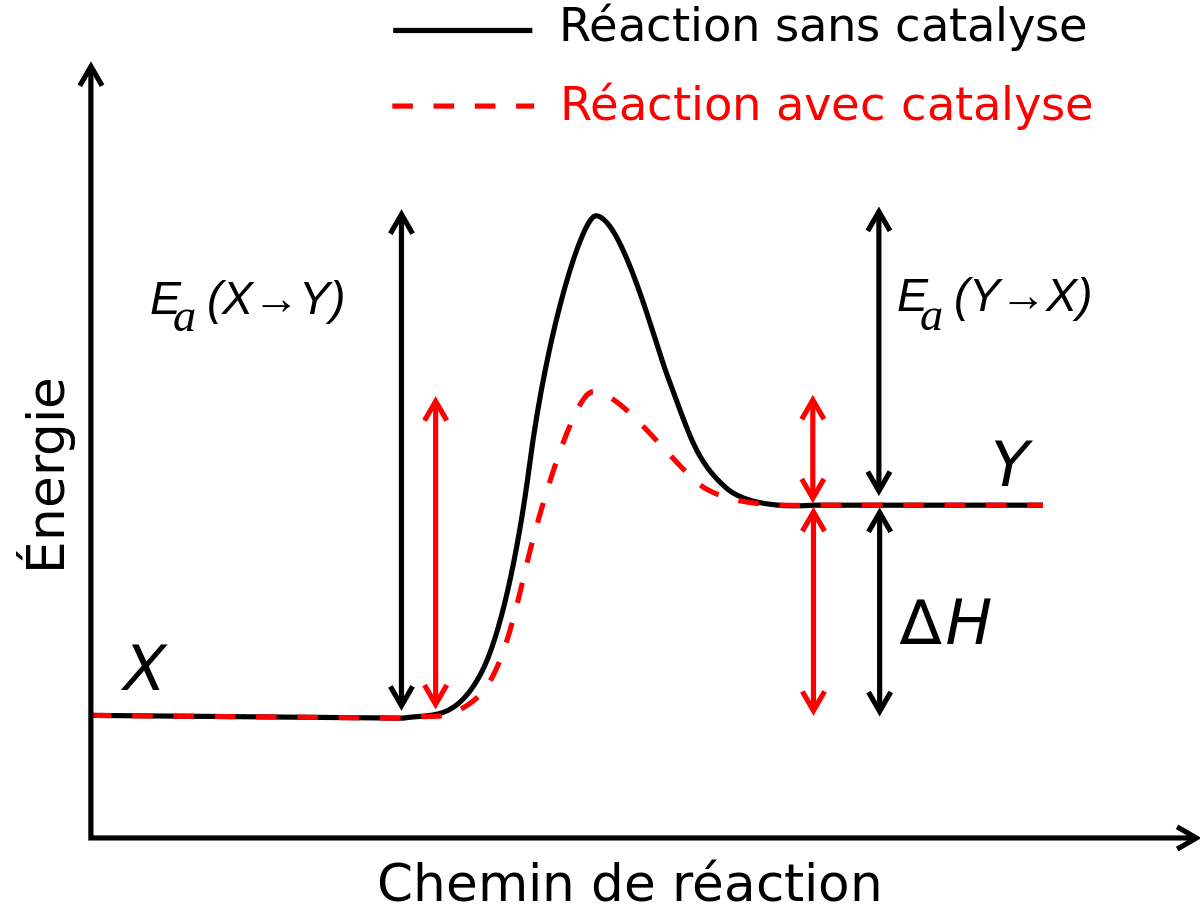
Le catalyseur augmente la vitesse de réaction en introduisant de nouveaux chemins de réaction (mécanisme), et en abaissant son énergie d'activation, ou énergie libre de Gibbs d'activation. Ce faisant il permet d'augmenter la vitesse, ou d'abaisser la température de la réaction. Le catalyseur ne modifie pas l'énergie libre de Gibbs totale de la réaction qui est une fonction d'état du système et n'a donc aucun effet sur la constante d'équilibre.
En plus de modifier la vitesse de réaction, le choix d'un catalyseur peut reposer sur d'autres paramètres :
- la sélectivité : un catalyseur sélectif va favoriser la production du produit désiré par rapport aux produits secondaires. Par exemple, quand on utilise l'argent métallique pour catalyser la réaction de formation de l'oxyde d'éthylène, à partir d'oxygène et d'éthylène, cette réaction est accompagnée par la formation plus favorable thermodynamiquement de CO2 et H2O ;
- la durée de vie : le catalyseur doit pouvoir demeurer intact après plusieurs cycles de réaction.
Les catalyseurs sont classés selon leur type :
- catalyseur homogène ;
- catalyseur hétérogène ;
- catalyseur de transfert de phase.
Analogie
Le terme "modifie ou augmente la vitesse de réaction" est une façon synthétique de faire le bilan de ce qui s'est passé, mais qui, strictement parlant, est erroné. En effet, il ne s'agit plus de la même transformation chimique ! Le "chemin réactionnel" avec catalyseur n'est pas le même que sans, et c'est pourquoi la vitesse est différente : il n'y pas les mêmes barrières de potentiel à franchir. Pour aller de la face nord à la face sud de la butte Montmartre, vous pouvez passer par le Sacré-Coeur, ou faire le tour par la rue Custine, la rue Caulaincourt et le boulevard Rochechouart. C'est cette dernière solution à laquelle vous invite le catalyseur
Mécanisme type
Le catalyseur réagit généralement avec un ou plusieurs réactifs pour donner un intermédiaire, qui donne le produit de la réaction tout en régénérant le catalyseur. Ci-dessous, un schéma typique de réaction entre deux composés A et B donnant un produit D en présence d'un catalyseur C.
A + B → AB (1) C + AB → ABC (2) ABC → CD (3) CD → C + D (4)
Bien que le catalyseur (C) soit consommé dans la réaction (1), il est régénéré par la réaction (4). Le bilan général de la réaction est donc bien A + B → D
Catalyse et énergie de réaction
Un catalyseur fonctionne en permettant un mécanisme alternatif mettant en jeu différents états de transition et des énergies d'activation plus basses. Ainsi, dans le cas d'une réaction bimoléculaire simple de type A + B, l'état de transition est remplacé par un intermédiaire réactionnel de plus basse énergie, accompagné par deux états de transition, eux-mêmes de plus basse énergie. L'effet de ce changement est que plus de collisions moléculaires ont l'énergie nécessaire pour atteindre l'état de transition. Ainsi, un catalyseur permet d'effectuer des réactions qui, bien que thermodynamiquement faisables, étaient cinétiquement impossibles, ou nettement plus lentes. En clair, un catalyseur abaisse l'énergie d'activation d'une réaction.
Un catalyseur ne peut pas rendre possible une réaction énergétiquement défavorable, pas plus qu'elle ne peut déplacer l'équilibre final. La réaction et la réaction inverse sont également catalysées (principe de microréversibilité). L'enthalpie libre de la réaction est inchangée.