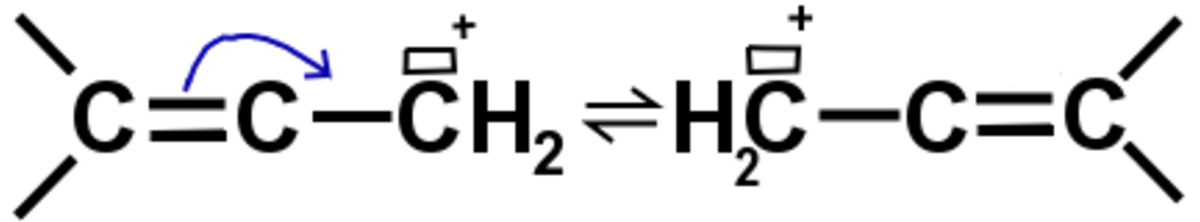Carbocation - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un carbocation, parfois appelé ion carbonium, est un ion dérivé d'un composé organique, qui possède une charge électrique positive sur un ou plusieurs atomes de carbone. Les carbocations sont des intermédiaires de réaction.
Historique
Découverte - Halochromie
L'étude des carbocations commence en 1902 quand les chimistes James Flack Norris et Kehrman découvrent indépendamment que lorsque des alcools de triphénylméthyl, incolores, sont mis en solution dans de l'acide sulfurique concentré, la solution prend une teinte jaune profonde. De même le chlorure de triphénylméthyl forme des complexes orange avec du chlorure d'étain ou d'aluminium. Johann Friedrich Wilhelm Adolf von Baeyer découvre en 1902 que les composés formés sont des sels.
- Ph3COH + H2SO4 → Ph3C+HSO4- + H2O (Ph signifie qu'il y a un substituant phényle)
Adolf von Baeyer surnomme la relation entre la couleur et la formation du sel halochromie, dont le vert de malachite est un bon exemple.
Intermédiaire de réaction
Les carbocations sont des intermédiaires de réaction, c’est-à-dire des molécules de courtes durées de vie, instables, qui apparaissent au cours des réactions chimiques. Cette idée est d'abord développée par Hans Meerwein dans son étude du réarrangement de Wagner-Meerwein. Les carbocations sont aussi impliqués dans des réactions de type SN1 (substitution nucléophile en deux étapes) et E1 (réaction d'élimination en deux étapes) et dans des réactions de réarrangement, comme le 1,2-réarrangement de Whitmore. Les chimistes furent d'abord réticents à accepter la notion de carbocation, et il fallut attendre longtemps avant que le Journal de la Société Américaine de Chimie (the Journal of the American Chemical Society) accepte les articles qui l'évoquaient. En 1962, George Andrew Olah dissout du fluorure de tert-butyl dans un superacide et observe par résonance magnétique nucléaire que le tert-butyl carbocation obtenu est stable.
Stabilité
Le carbocation est instable parce qu'il est chargé positivement. Il sera donc plus stable si cette charge est partiellement compensée.
Effet inductif
Lorsque deux atomes différents sont liés les électrons sont globalement plus proches de l'atome le plus électronégatif (qui attire le plus les électrons), c'est l'effet inductif dû à la polarisation de la liaison. L'atome le plus électronégatif sera donc chargé un peu négativement, l'autre atome un peu positivement.
Ainsi le carbocation peut compenser partiellement sa charge positive, donc se stabiliser. Le carbone chargé bénéficie d'un effet inductif donneur s'il est relié à un ou plusieurs atomes (ou groupes d'atomes) moins électronégatifs : il sera stabilisé. Inversement, s'il est relié à un ou plusieurs atomes (ou groupes d'atomes) plus électronégatifs, il sera moins stable.
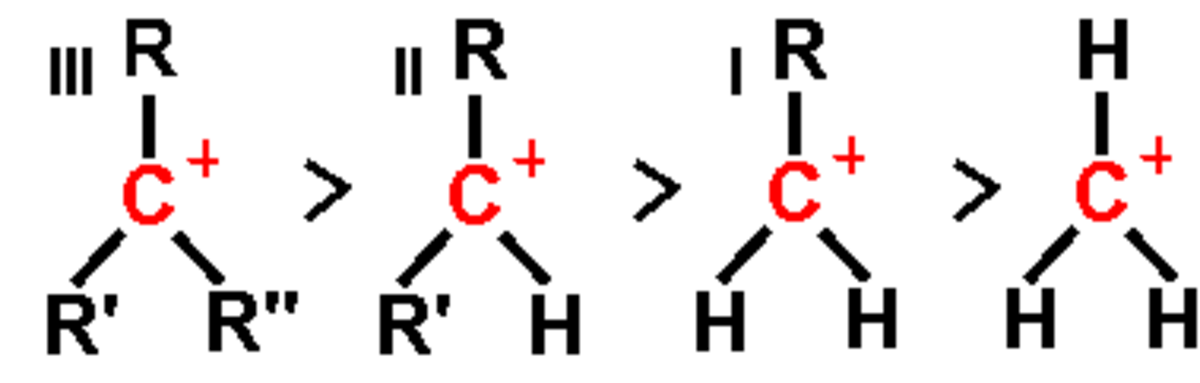
Les groupements alkyles sont moins électronégatifs que le carbone. Donc plus le carbone chargé est lié à un nombre important de tels groupements, plus le carbocation sera stable. Un carbocation tertiaire (le carbone chargé est lié à trois groupes alkyles) est plus stable qu'un secondaire, lui même plus stable qu'un primaire.
A l'inverse, le carbone chargé sera fortement déstabilisé s'il est lié à un groupement nitrile (-CN), très électronégatif.
Effet mésomère
Lorsque dans un composé chimique des électrons sont délocalisés on parle de mésomérie. Dans ce cas on trouve plusieurs structures électroniques possibles, plusieurs schémas possibles. Aucun de ces schémas ne décrit à lui seul la réalité, c'est "la somme" de ces schémas qui s'approche le plus de la réalité.
Les carbocations peuvent être stabilisés par effet mésomères. En effet un carbocation possède une orbitale 2p vide, et c'est entre des orbitales 2p proches que les électrons peuvent se délocaliser. Et si la charge positive du carbocation profite d'un effet mésomère, elle sera elle aussi délocalisée et en quelque sorte répartie sur tout le composé, qui sera alors plus stable.
L'effet mésomère est plus important que l'effet inductif. Le composé pris en exemple est, si on se préoccupe seulement de l'effet inductif, très instable : c'est un carbocation primaire. Mais dans ce composé les électrons sont délocalisés du fait de la double liaison, le composé existe donc sous deux formes mésomères et est donc relativement stable.