Cancer - Définition
La liste des auteurs de cet article est disponible ici.
Biologie
Typologie
On distingue généralement :
- Les carcinomes : cancer d'un épithélium, c'est-à-dire une surface composée uniquement de cellules
- Les sarcomes : cancers proliférant dans des tissus conjonctifs comme les os.
- Les cancers hématopoïétiques : cancer des cellules sanguines.
On peut les classer selon les organes touchés, avec par exemple types de cancer :
- Le cancer du sein
- Le cancer du côlon : cancer du côlon et, proche, celui du rectum
- Le cancer du pancréas
- Le myélome multiple : cancer de la moelle osseuse
- les leucémies : cancers du sang
- Le sarcome de Kaposi : cancer des vaisseaux sanguins
- Lymphomes : Maladie de Hodgkin et Lymphome non-hodgkinien.
- Le cancer des testicules
Il existe presque autant de sources de cancer que de tissus dans l'organisme. Certains sont toutefois plus fréquents que d'autres.
Génétique et cancer
Les cancers sont des pathologies génétiques c’est-à-dire qu’ils ont pour origine une modification quantitative et/ou qualitative de nos gènes. Comme il s’agit d’altérations génétiques somatiques qui ne sont présentes que dans le tissu malade, la plupart des cancers ne sont donc pas eux-mêmes héréditaires, seul un terrain plus ou moins favorable pouvant l'être. Les cancers familiaux (10% des cancers humains) sont associés à une altération constitutionnelle (ou germinale) d’un gène. Cette altération est donc présente dans toutes les cellules de notre organisme, gamètes incluses. Elle peut être transmise à la descendance.
Il y a trois grandes catégories de gènes associés aux pathologies cancéreuses : les oncogènes, les gènes suppresseurs de tumeurs et les gènes de réparation de l’ADN.
- Les oncogènes (appelés proto-oncogènes lorsqu'ils sont dans leur état normal et oncogènes losqu'ils sont mutés, ou c-onc) sont les régulateurs positifs de la prolifération cellulaire. Ils deviennent hyperactifs et leur modification est dominante car il suffit qu'une des deux copies du gène soit modifiée. On a identifié actuellement plus de 100 oncogènes. Les plus connus sont les gènes Ha-ras, myc, ou abl.
- La seconde catégorie comprend les gènes suppresseurs de tumeurs qui sont des régulateurs négatifs de la prolifération cellulaire (les freins). Les deux copies de ces gènes sont inactivées dans les cancers.
- La troisième catégorie correspond aux gènes des multiples systèmes de réparation qui sont capables de détecter et de réparer les lésions de l’ADN qui ont modifié les oncogènes ou les gènes suppresseurs de tumeur. Ces systèmes de réparation sont également inactivés dans les cellules cancéreuses.
Transformation cellulaire
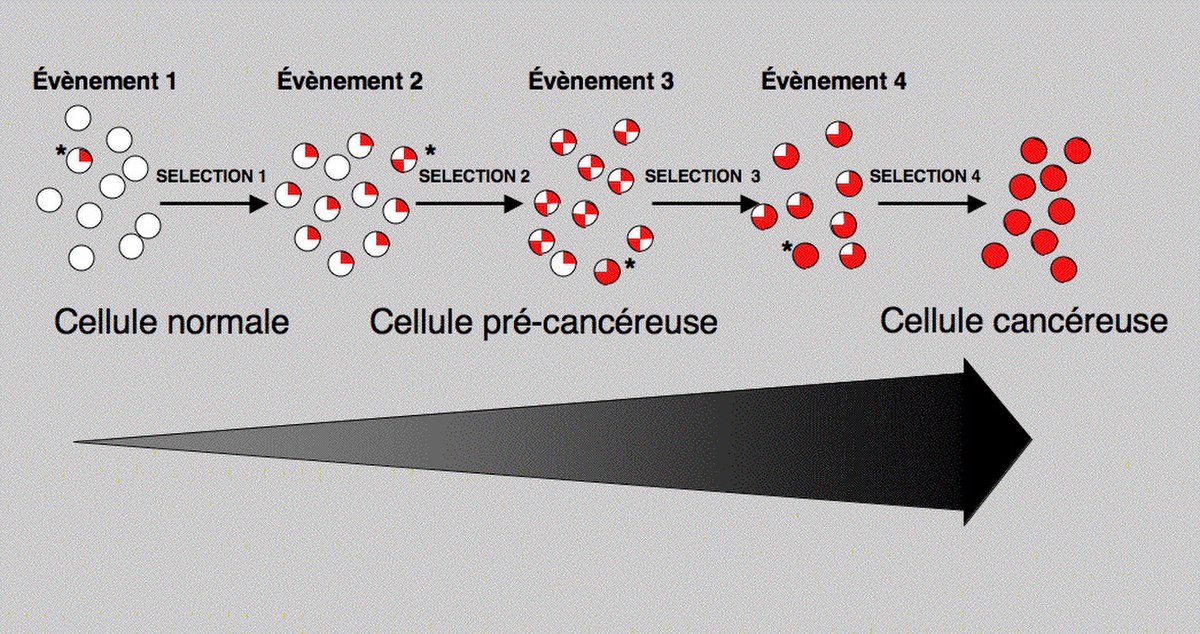
La transformation cellulaire correspond au passage d’une cellule eucaryote normale vers une cellule eucaryote cancéreuse. À ne pas confondre avec la transformation bactérienne qui est un phénomène tout à fait différent.
Contrairement aux pathologies génétiques comme la mucoviscidose, les myopathies ou certaines hémophilies qui sont des pathologies monogéniques (un seul gène est généralement altéré), le cancer est une pathologie multigénique. Chaque cancer a pour origine l’altération de 10 à 20 gènes. Ces altérations se produisent de manières successives, chacune d’entre elles favorisant la suivante (voir encadré). Cette suite d’altérations se produit généralement sur une très longue plage chronologique (5 à 20 ans). Cette suite d’altération n’est pas aléatoire et pour chaque type de cancer, on a pu mettre en évidence d'une part une certaine spécificité des gènes altérés et d'autre part une chronologie dans le développement des évènements.
Dans les cancers du côlon, cette succession d’événements comprend (entre autres) tout d’abord l’inactivation du gène suppresseur de tumeur APC, puis une mutation de l’oncogène Ha-ras suivi de l’inactivation du gène suppresseur de tumeur p53. Il y a d’autres événements qui restent à identifier. Le point essentiel est la spécificité des gènes altérés et leur chronologie. Dans un autre type de cancer, les gènes impliqués et la chronologie sont totalement différents. APC n’est altéré que dans les cancers du côlon et jamais dans les cancers de la peau. Par contre l’altération de p53 peut être retrouvée dans pratiquement tous les types de cancers. Dans le cancer de la peau, contrairement au cancer du côlon, l’altération du gène p53 est l’un des premiers événements. Cette très grande diversité génétique est à la base de l’hétérogénéité de la pathologie cancéreuse. À l’intérieur même d’un type de cancer particulier comme le cancer bronchique, existent plusieurs sous-types (cancer bronchique à petites cellules, adénocarcinome, cancer bronchique à grandes cellules, etc.) chacun étant associé à des altérations génétiques particulières. La situation est identique pour d’autres cancers comme celui du sein, de l’estomac ou de la peau, chaque organe pouvant être associé à plusieurs types de cancers suivant le type histologique de la cellule ayant été à l’origine de la pathologie.
Chronologie de la transformation cancéreuse
La formation d'un cancer - au sens strict - comporte 2 étapes distinctes et nécessairement successives :
- Cancérogenèse
- Tumorogenèse
- Carcinogenèse
C'est l'action de substances dites carcinogènes. Elles entraînent des anomalies génétiques touchant l'architecture ou la séquence de l'ADN. A ce stade, le cancer en formation n'est cliniquement pas observable et il n'a pas de conséquence fonctionnelle.
- Cancérogenèse
Ce stade de la transformation cancéreuse nécessite deux étapes : l' initiation et la Promotion Ces deux étapes sont obligatoirement successives et l'initiation précède toujours la promotion, sans quoi le processus cancéreux s'arrête. L'initiation correspond à l'accumulation des anomalies génétiques, la promotion à la réception par la cellule de facteurs de prolifération qui vont entraîner les divisions. Ces signaux vont donc pérenniser les anomalies au cours des divisions, et ainsi assurer la descendance de la cellule anormale, qui va de surcroît accumuler de nouvelles anomalies génétiques. (voir Transformation cellulaire).
La transformation cellulaire comporte deux éléments majeurs, l’ immortalisation (les cellules deviennent incapables d'initier leur propre mort (apoptose) ou deviennent indépendantes aux signaux extérieurs qui la déclenchent) et la perte d’homéostasie (caractérisée normalement par une balance divisions/mort qui assure le maintien de la taille et de la fonctionnalité d'un organe, les cellules cancéreuses perdent la sensibilité aux signaux qui régulent la prolifération).
L' Initiation est la conséquence de la carcinogenèse. L'action des carcinogènes mute des gènes importants dans le maintien de l'intégrité et des caractéristiques de chaque type cellulaire. Il en résulte des pertes ou gains de fonctions cellulaires : activation ou dérépression d'un oncogène, inhibition ou répression d'un gène suppresseur de tumeur. Les oncogènes sont souvent des activateurs de la multiplication ou des inhibiteurs de l'apoptose (BCL, BCLX1...) tandis que les gènes suppresseurs sont inducteurs de l'apoptose ou bloquent le cycle cellulaire (P53, BAC...).
La Promotion est caractérisée par une grande instabilité génomique et une augmentation de la perte d'homéostasie. L'instabilité génomique est due à des mutations de deux types de gènes :
- Gate keeper genes : ils assurent le contrôle du passage à une étape ultérieure du cycle cellulaire, ce sont des "points de contrôle" du cycle cellulaire. Une perte de fonction de ces gènes permet à la cellule cancéreuse de passer rapidement à la phase ultérieure du cycle cellulaire, donc in fine de proliférer de façon incontrôlée.
- Care taker genes : ils assurent physiologiquement la réparation des anomalies liées à l'ADN. Leur inactivation entraîne une instabilité accrue et une accumulation d'anomalies génétiques (mutation, perte d'hétérozygotie, modifications épigénétiques : hypo/hyperméthylation, désacétylation...).
Ces points de contrôle et de réparation altérés, la cellule cancéreuse a désormais perdu la capacité à "reconnaître sa vieillesse", initier sa mort et réparer les dommages de son ADN. La réponse aux signaux de croissance physiologiques est en outre disproportionnée, puis la cellule commence à produire ses propres signaux de prolifération (cf. infra) : la croissance incontrôlée d'un pool de cellules n'a alors plus de limite.
A ce stade, le cancer est infraclinique: c'est une masse de cellules qui survit dans l'organisme. L'environnement des cellules cancéreuses (ou stroma, microenvironnement) est dit non coopératif : il ne fournit pas aux cellules cancéreuses les nutriments et le soutien que leur développement réclame. Cette phase est critique dans le développement clinique du cancer : si le stroma reste non-permissif, le cancer n'évolue pas, ou alors très lentement. Si en revanche il s'établit une réciprocité de maintien entre cancer et stroma (le cancer envoie des signaux permissifs au stroma, qui se modifie en faveur du cancer et va lui apporter nutriments et soutien, le cancer grossit, produit de plus en plus de signaux permissifs, etc.), l'évolution du cancer reprend et passe à un stade clinique.
Le stroma devient permissif lorsqu'il est le siège d'une néoangiogenèse (sécrétion par la tumeur de facteurs de croissance angiogéniques (VEGF), apparition des récepteurs à ces facteurs sur le stroma (VEGF-R)) et de l'apparition de récepteurs tumoraux aux facteurs de croissances cellulaires (boucle autocrine) ou microenvironnementaux (boucle paracrine).
- Tumorogenèse
Il s'agit du développement du cancer donnant des conséquences cliniques : il grossit dans des limites histologiques précises (on parle de cancer in situ), puis les dépasse et devient donc invasif avec dissémination très probable de métastases.
La néoangiogenèse et la mise en place d'une circulation sanguine stable et relativement efficace est un préalable indispensable à cette phase : la croissance tumorale est telle qu'elle ne peut plus se contenter d'une diffusion à partir d'un stroma non permissif mais nécessite des apports importants et dédiés. La tumeur grossit jusqu'à atteindre la lame basale : le cancer est dit in situ et son risque de métastase est faible. La croissance tumorale continue et la membrane basale se rompt, le cancer devient invasif : les cellules cancéreuses ont alors de grandes facilités à atteindre les courants métastatiques (circulations lymphatique pour les carcinomes et veineuse pour les sarcomes) et la dissémination dans le corps débute.
Origine des cancers
Environs 15 % des cancers humains peuvent être associés à des agents infectieux. Cela peut être des virus (HBV et cancer du foie, HPV et cancer du col de l’utérus, EBV et lymphome de Burkitt), plus rarement des bactéries (Helicobacter et cancer gastrique) ou encore plus rarement des parasites (Schistosomes et cancer du foie). Dans tous ces cas, outre l’infection, on trouve également des altérations d’oncogènes ou de gènes suppresseurs dans les tumeurs. L’agent infectieux n’intervient qu‘à une étape du processus de transformation cellulaire.
L’origine des altérations qui modifient les oncogènes et les gènes suppresseurs est multiple. On les classe généralement en deux grandes catégories, exogène et endogène.
- L’origine exogène correspond à toutes les expositions environnementales auxquelles un organisme est soumis. Cela va du tabac aux ultraviolets du soleil en passant par l'amiante, les radiations gamma, l’alcool et de nombreuses autres substances auquel un individu est exposé volontairement ou involontairement. Elles peuvent agir directement au niveau de notre ADN et provoquer des altérations comme certaines molécules dans le tabac ou les ultraviolettes ou provoquer des états inflammatoires favorisant l’apparition de cellules cancéreuse (alcool).
- Les altérations d’origine endogène sont provoquées en partie par des molécules issues de notre métabolisme comme les espèces réactives à l’oxygène. Chaque jour notre ADN subit des millions d’agressions de la part de ces molécules mais dans la très grande majorité des cas, celles-ci sont réparées de manière très efficace. Néanmoins, il suffit d’une défaillance dans la réparation d’un gène important pour enclencher ou continuer un processus de transformation cellulaire. Des travaux récents (2007) suggèrent que les systèmes de réparation de l’ADN ont une efficacité qui diminue avec l’âge.
En 2000 R. Weinberg et D. Hanahan ont suggéré que la transformation cellulaire passe par l’acquisition d’au moins six propriétés :
- Indépendance vis-à-vis des signaux stimulant la prolifération. Les cellules normales ne se divisent que lorsqu'elles reçoivent un stimulus particulier. Les cellules tumorales n’ont plus besoin de ce signal.
- Insensibilité aux signaux inhibiteurs
- Abolition de l’apoptose ou mort cellulaire programmée. En cas de stress ou d’anomalie ne pouvant pas être éliminée, une cellule normale se suicide en utilisant l’apoptose. Les cellules tumorales ont inactivé tous ces mécanismes pour mieux survivre.
- Capacité proliférative illimitée : le nombre usuel de divisions cellulaires pour une cellule humaine est de 50 à 60 (sénescence cellulaire, limite de Hayflick), après quoi elle cesse de pouvoir se diviser (voir article Télomère). Les cellules tumorales continuent de se diviser sans limite visible grâce à l’activité de la télomérase qui est fortement active dans toutes les cellules cancéreuses.
- Capacité de susciter l’angiogenèse. Les cellules tumorales (et la tumeur) ont un besoin important en oxygène pour survivre. Elles vont donc stimuler la formation de nouveaux vaisseaux sanguins afin d’oxygéner la tumeur.
- Acquisition d’un pouvoir invasif. Les cellules tumorales sont capables de passer à l’intérieur d’un vaisseau sanguin afin d’être transportées dans un autre organe où elles vont générer une seconde tumeur (métastase)
Évolution
De son foyer initial, le cancer va (en dehors de tout traitement ou si le traitement n'est pas efficace) :
- se développer de manière locale. Il provoque dans ce cas une compression des organes voisins, voire un envahissement et une destruction des tissus adjacents ;
- se développer de manière régionale. Il envahit les ganglions lymphatiques, où logent les cellules du système immunitaire ;
- se propager à distance de la tumeur initiale et former des métastases. Il y a souvent une confusion chez les patients et leur famille : un cancer du sein avec des métastases au niveau du cerveau ne donne pas un cancer du cerveau ; c'est toujours le cancer du sein initial, mais qui s'est développé ailleurs. Il faut continuer à le traiter comme un cancer du sein.
L'évolution dépend du type du cancer et de sa prise en charge : certains ne font que très peu de métastases et sont très sensibles aux traitements permettant d'aboutir dans la grande majorité des cas à une rémission complète et prolongée (ce terme de rémission est spécifique de la cancérologie et diffère de guérison par l'absence de certitude quant à une récidive à court, moyen ou long terme). D'autres sont encore très difficilement maîtrisables et peuvent entraîner le décès à court terme. Une évaluation précise du type du cancer auprès d'un médecin spécialisé est donc indispensable.
De quoi meurt-on quand on « meurt d'un cancer » ?
C'est là une question fréquemment posée aux médecins par les patients ou leur famille, qui ont peine à croire qu'une petite tumeur (du moins en apparence) menace tout un organisme.
La réponse est invariable : la vie dépend de la bonne marche d'un certain nombre de fonctions, dont la respiration (au sens large, en incluant la distribution d'oxygène par la circulation sanguine), la digestion et l'excrétion (reins, foie). Selon celui des trois systèmes qui est altéré par les cellules cancéreuses, par exemple, le patient meurt — si l'on n'arrive pas à juguler la progression du mal — :
- d'insuffisance respiratoire ;
- de dénutrition ;
- d'empoisonnement, par accumulation de substances toxiques normalement filtrées et excrétées par les reins et le foie