Atome - Définition
La liste des auteurs de cet article est disponible ici.
Le modèle actuel : modèle de Schrödinger
La naissance de la mécanique ondulatoire de Louis de Broglie 1924, généralisée par Erwin Schrödinger en 1926 amène à proposer un nouveau modèle, dont les aspects relativistes furent décrits par Paul Dirac en 1928 ; il permet d'expliquer la stabilité de l'atome et la description des termes spectroscopiques.
Dans ce modèle, les électrons ne sont plus des billes localisées en orbite, mais des nuages de probabilité de présence. Ce point de vue, révolutionnaire, peut choquer en première approche. Cependant la représentation que l'on pouvait se faire d'un électron — une petite bille ? — était dictée par les formes observées dans le monde macroscopique, transposées sans preuves dans le monde microscopique. Il faut bien se pénétrer du fait que ce que l'on connaît de l'électron ne repose que sur des manifestations indirectes : courant électrique, tube cathodique (télévision)…
Depuis les années 1930, on modélise ainsi l'électron par une « fonction d'onde » dont le carré de la « norme représente la densité de probabilité de présence ». Pour représenter fidèlement les propriétés de l'électron, on ne dispose que des fonctions mathématiques compliquées. Cette abstraction rebute encore bien des physiciens. Nous allons essayer de donner une image de cette notion de fonction d'onde, image nécessairement imparfaite.
- Imaginons que hors de l'atome, l'électron soit une petite bille. Lorsque l'électron est capturé par l'atome, il se « dissout » et devient un nuage diffus, il s'« évapore ». Quand on l'arrache de l'atome, il redevient une petite bille, il se « recondense ». Il existe d'autres exemples d'objet qui changent de forme, par exemple, hors de l'eau, le sel est sous forme de cristaux ; mis dans l'eau, il se dissout, et si l'on fait s'évaporer l'eau, on retrouve des cristaux. Le sel change de forme (cristal compact ou dissous dans l'eau), mais on a tout le temps du sel.

De manière un peu plus exacte : un électron, hors d'un atome, est représenté par un paquet d'ondes, qui peut être considéré, dans certaines limites, comme une petite bille. La mécanique quantique démontre qu'un tel paquet d'ondes s'étale au cours du temps ; au contraire, un électron d'un atome conserve la structure de la fonction d'onde associée à l'orbite qu'il occupe (tant qu'il n'est pas éjecté de l'atome). La mécanique quantique postule donc, non la conservation de la forme (non connue) de l'électron, mais l'intégrale de la probabilité de présence.
Dans le modèle de Schrödinger, les nuages correspondant aux différents électrons s'interpénètrent ; il n'est pas question de se donner une représentation individuelle des électrons chacun sur son orbite, comme cela était dans le cas du modèle de Bohr. Cela est d'autant plus vrai que les électrons sont des particules identiques indiscernables. Les effets d'échange amènent à considérer que chaque électron de l'atome est à la fois sur chaque orbitale occupée (correspondant à une configuration électronique donnée). L'ionisation de l'atome (l'arrachement d'un électron de l'atome) peut alors être représentée par le schéma simplifié ci-dessous.
Pour éviter des complications inutiles, on considérera l'atome le plus simple afin de montrer quelques schémas dévoilant les points fondamentaux du modèle :
- le nuage électronique associé à l'état fondamental, révélant (comme d'autres états) la possibilité pour l'électron d'être au sein du noyau, ce qui a des conséquences en physique nucléaire : capture électronique.
- le nuage électronique associé à une combinaison linéaire de deux orbitales associées au premier niveau excité. Cet exemple montre la possibilité d'obtenir des nuages électroniques pointant vers l'extérieur de l'atome… nous sommes ainsi préparés aux liaisons moléculaires.
Soit ρ(r, θ, φ) la densité de probabilité de présence au point de coordonnées sphériques (r, θ, φ). Pour l'état fondamental, la densité de probabilité, ρ, est maximale au centre de l'atome. Considérons maintenant la densité radiale de probabilité de présence (à la distance r du noyau, toutes les directions confondues) :
-
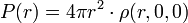
cette densité radiale est maximale pour r = r1 de la première orbite du modèle de Bohr (dans l'expression ci-dessus, on a tenu compte de la symétrie sphérique de ρ, identique pour toutes les directions). on a en fait :
- ρ(0,0,0) > ρ(r1,0,0), mais P(0) < P(r1).
En fonction de l'état quantique de l'électron (fondamental, excité …) ces nuages peuvent prendre différentes formes, qui sont décrites en particulier par les harmoniques sphériques. La forme la plus simple est la symétrie sphérique, montrée en particulier, ci-dessus, dans le cas de l'état fondamental, |1s>.
Des combinaisons linéaires de fonctions d'onde, utilisant des harmoniques sphériques distinctes, permettent l'apparition d'une anisotropie qui va devenir essentielle pour le passage de la notion d'atome à celle de molécule. Le schéma ci-contre montre une coupe de la densité de probabilité de présence de l'orbitale hybride |2spz > de l'atome d'hydrogène, coupe contenant Oz axe de symétrie de l'orbitale atomique. Pour cet exemple, l'axe Oz devient une direction privilégiée, mais de plus la densité de probabilité de présence s'étale plus loin pour une orientation donnée.
Ce modèle permet d'expliquer :
- la stabilité de l'atome, les charges sont accélérées, mais elles sont contraintes par la mécanique quantique (relations d'incertitude) ;
- la forme des molécules : orientation préférentielle des nuages électroniques ;
- l'organisation des cristaux : le nuage électronique se comporte comme une coquille dure ;
- les effets spectroscopiques (la quantification des échanges d'énergie) : le nuage ne peut prendre que des formes déterminées, notamment en ce qui concerne la distance r1 du maximum de densité au noyau.
On notera pour terminer que des corrections relativistes sont à apporter, dans le cas des atomes de numéro atomique élevé, pour la détermination des niveaux internes (les vitesses des électrons sur les orbites du modèle de Bohr sont alors importantes).

















































