Atome - Définition
La liste des auteurs de cet article est disponible ici.
Formation et évolution des atomes
Les atomes constituent environ 4 % de l'énergie totale observable de l'univers, avec une concentration moyenne d'un atome pour quatre mètres cubes. Dans le milieu interstellaire d'une galaxie telle que la Voie Lactée, la concentration d'atomes varie selon les régions entre cent mille et un milliard d'atomes par mètre cube, bien que l'environnement immédiat du Soleil soit bien plus ténu : à peine cinquante mille atomes par mètre cube, ce qui définit précisément la bulle locale comme une cavité dans le milieu interstellaire formée par l'explosion de supernovae voisines il y a deux à quatre millions d'années. Les étoiles se forment à partir de nuages denses, et les réactions de fusion nucléaire qui se déroulent en leur sein conduisent à la formation d'éléments chimiques plus lourds que l'hydrogène, l'hélium et le lithium (voire, peut-être, le béryllium) produits à la suite du big bang.
Plus de 95 % des atomes de la Voie Lactée se trouvent dans les étoiles, et les atomes « visibles » de notre galaxie représentent environ 10 % de sa masse : le reste de cette masse serait constitué d'une mystérieuse matière noire.
Nucléosynthèse
Dans les premières minutes de l'existence de l'univers, les quatre éléments les plus légers se sont formés au cours de la nucléosynthèse primordiale : environ 75 % d'hydrogène 1H, 25 % d'hélium 4He, 0,01 % de deutérium 2H, et des traces (de l'ordre de 10-10) de lithium 7Li, voire peut-être aussi de béryllium. Cette nucléosynthèse aurait été trop brève pour permettre la synthèse d'éléments plus lourds que le béryllium et pour permettre la fusion du deutérium. Les atomes proprement dits, avec leur nuage électronique, se seraient formés lors de la recombinaison, environ 377 000 ans après le Big Bang, et les premiers quasars et étoiles se seraient formés après 150 millions d'années.
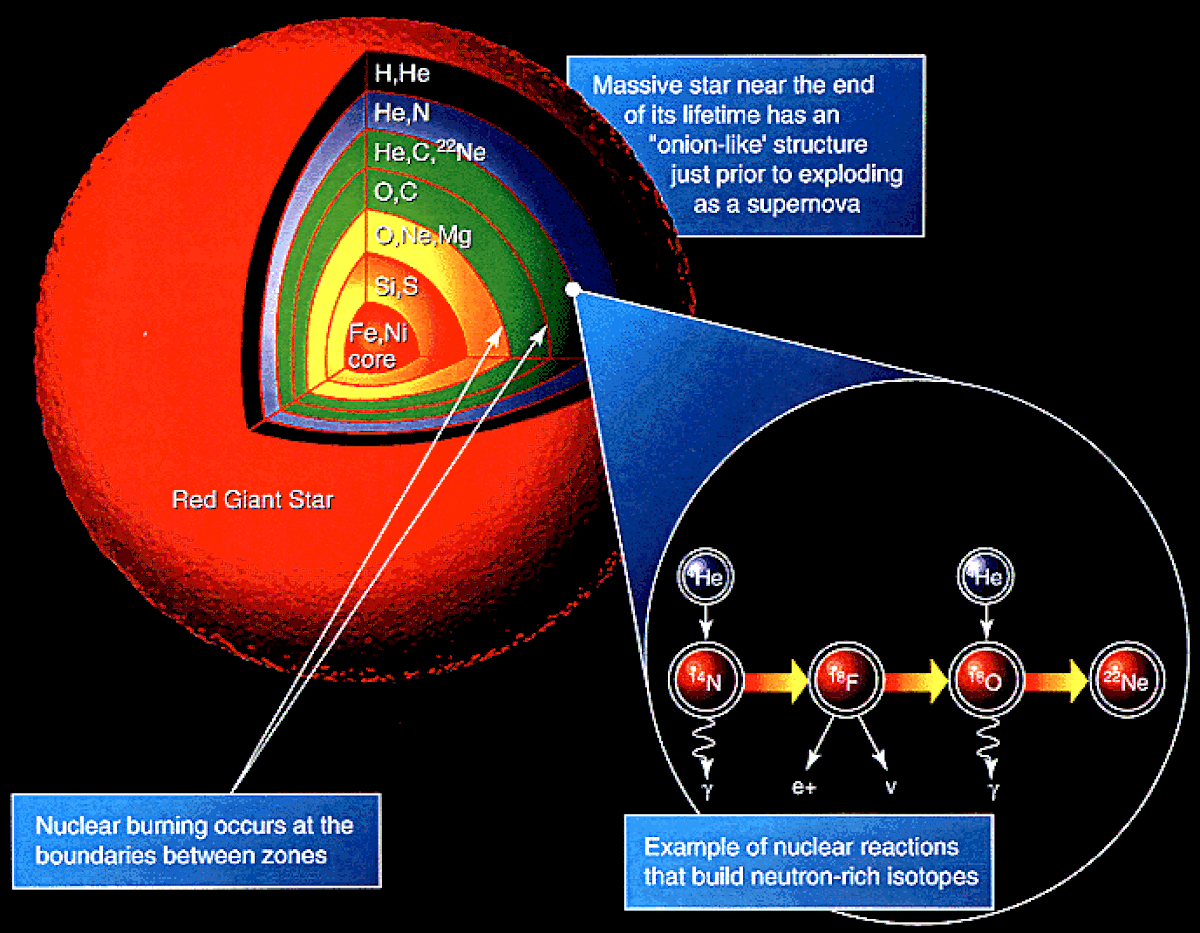
La nucléosynthèse stellaire aurait alors pris le relais pour former tous les éléments chimiques jusqu'au fer par fusion successive de noyaux d'hélium :
- Fusion de l'hydrogène :
- Réaction proton-proton
- Cycle carbone-azote-oxygène (CNO)
- Fusion de l'hélium :
- Fusion des éléments plus lourds jusqu'au fer :
A ce stade, la fusion cesse d'être exothermique et des réactions nécessitant un milieu très énergétique interviennent pour former les éléments plus lourds : capture neutronique (processus r, processus s), protonique (processus rp), et photodésintégration (processus p), qui interviennent à la toute fin de vie des étoiles, même peu massives, et surtout lors de l'explosion de supernovae.
Sur Terre
Selon toute vraisemblance, la grande majorité des atomes qui constituent la Terre étaient déjà présents dans la nébuleuse solaire, dont l'effondrement gravitationnel aurait engendré les système solaire. Les atomes apparus depuis proviennent le plus souvent de la désintégration radioactive d'éléments primordiaux instables, et les rapports isotopiques des éléments correspondants offrent le moyen d'évaluer l'âge de la Terre par datation radiométrique. Par ailleurs, l'abondance naturelle de l'hélium 3 sur Terre par rapport à l'hélium 4 des gisements de gaz naturel permet de déduire que 99 % de l'hélium 4 terrestre provient de la radioactivité α. D'autres atomes, qualifiés de « cosmogéniques, » proviennent de l'interaction des rayons cosmiques avec l'atmosphère terrestre : c'est le cas bien connu du carbone 14, mais aussi, par exemple, du béryllium 10. Enfin, de très nombreux atomes synthétiques sont produits en laboratoire à des fins essentiellement scientifiques, parfois militaires, rarement industrielles (en raison du coût prohibitif des matériaux ainsi produits), tels que le silicium 42 (pour valider certaines hypothèse sur le modèle en couches décrivant la structure nucléaire), le plutonium 239 (matériau de choix pour les armes nucléaires), le technétium 99m (très utilisé en médecine nucléaire) ou encore l'américium 241 (employé industriellement dans les détecteurs de fumée).
Atomes de Rydberg
Sous certaines conditions, il est possible d'exciter des atomes, par exemple avec un laser à colorant, pour placer certains de leurs électrons dans des orbitales atomiques correspondant à un nombre quantique principal n égal à plusieurs dizaines d'unités, voire supérieur à 100. De tels atomes sont appelés atomes de Rydberg. Ils ont des propriétés remarquables, telles qu'une très grande susceptibilité électrique et magnétique, une relative stabilité, et des fonctions d'onde électroniques approchant, dans une certaine mesure, l'orbite décrite par un électron en mécanique classique autour du noyau. Les électrons de cœur écrantent le champ électrostatique du noyau du point de vue de l'électron périphérique, pour lequel le potentiel du noyau est identique à celui d'un atome d'hydrogène. Le comportement de cet électron particulier est particulièrement bien décrit par le modèle de Bohr, pourtant très insuffisant pour modéliser les atomes « conventionnels ».
Les atomes de Rydberg ont une taille très supérieure à celle des atomes à l'état fondamental : l'état d'excitation jusqu'à n = 137 d'un atome d'hydrogène correspond à un rayon atomique d'environ 1 μm, soit cinq ordres de grandeur au-dessus du rayon d'un atome d'hydrogène à l'état fondamental (n = 1). Ils ne peuvent exister dans le milieu naturel terrestre car leur énergie d'ionisation y est bien inférieure à l'énergie thermique, mais repésentent une partie importante de la matière du milieu interstellaire, où ils peuvent persister longtemps sans interaction avec d'autres atomes ni avec des champs électriques ou magnétiques susceptible de provoquer leur retour à l'état fondamental. La raie spectrale à 2,4 GHz révélatrice de la transition de nombre quantique principal entre n = 109 et n = 108 de l'atome d'hydrogène est ainsi très fréquemment observée par les astronomes.
Compte tenu de leur susceptibilité électrique et magnétique très élevée, les propriétés électriques et magnétiques des milieux contenant une proportion significative d'atomes de Rydberg sont sensiblement altérées par leur présence.
Formes atomiques rares ou hypothétiques
Différentes formes d'atomes exotiques ont été conjecturées, et parfois observées. C'est le cas, par exemple, des atomes muoniques, dans lesquels un électron est remplacé par un muon : ce dernier étant plus massif qu'un électron, il présente des orbitales plus proches du noyau, ce qui donne des « atomes » plus petits. De la même façon, un électron peut être remplacé par un hadron, tel qu'un méson, une particule Σ-, voire un antiproton. Le seul atome exotique ayant une durée de vie significative — qui n'excède cependant pas 2,2 μs — est le muonium, résultant de l'interaction d'un électron avec un muon μ+ servant de « noyau ». Ces formes d'atomes sont utiles pour vérifier certains aspects du modèle standard de la physique des particules, notamment les interactions élémentaires.
L'interaction d'un positon avec un antiproton donne un atome d'antihydrogène, qui est un atome d'antimatière. Il existe a priori un « antiatome » pour chaque atome ; la production d'antimatière demeure néanmoins une expérience particulièrement coûteuse en énergie, et seul l'antihydrogène 1H a été synthétisé à ce jour.
Il existe également tout une variété d'atomes « conventionnels » mais néanmoins absents du milieu naturel et donc produits artificiellement. Ces éléments synthétiques sont, à deux exceptions près, des transuraniens, qui sont de plus en plus instables à mesure que leur numéro atomique augmente.