Atome - Définition
La liste des auteurs de cet article est disponible ici.
Propriétés
Noyaux atomiques
Moment magnétique nucléaire
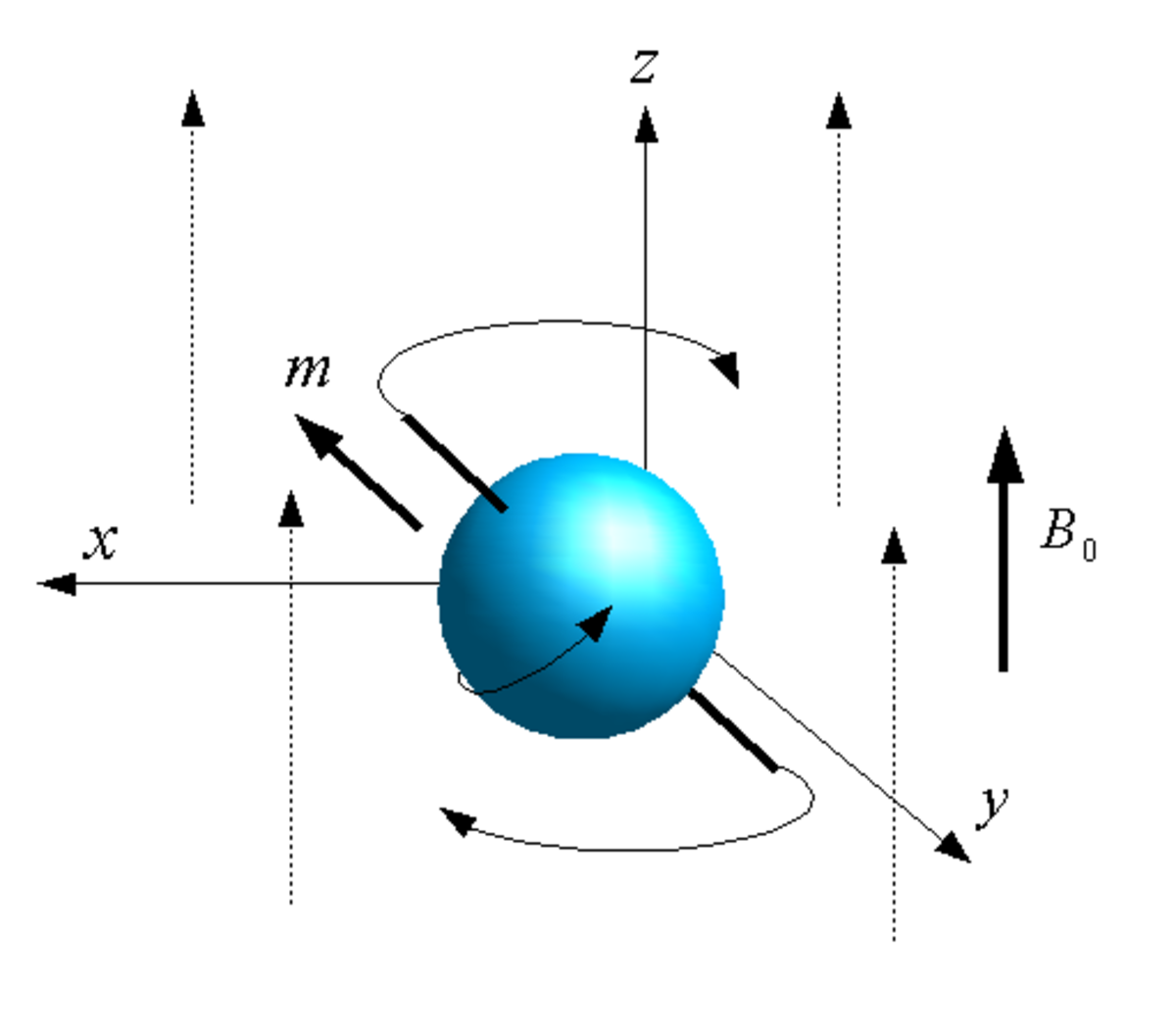
Les particules élémentaires possèdent un nombre quantique appelé spin analogue à un moment angulaire et mesuré en unités de constante de Planck réduite (parfois appelée « constante de Dirac ») désignée par le symbole ħ, qui se lit « h barre ». C'est également le cas des protons et des neutrons du noyau atomique, dont la résultante des spins se manifeste par un moment magnétique nucléaire. La valeur de ce dernier est spécifique à chaque noyau ; à l'état fondamental, elle est nulle pour les nucléides ayant à la fois un nombre pair de protons et un nombre pair de neutrons.
Cette propriété est mise à profit en imagerie par résonance magnétique (IRM), fondée sur la résonance magnétique nucléaire (RMN) : un matériau soumis d'une part à un rayonnement électromagnétique, et d'autre part à un champ magnétique intense (de l'ordre du tesla) qui oriente les noyaux atomiques dans une direction privilégiée (mais en les séparant en deux populations correspondant aux deux sens de cette direction), absorbe une partie du rayonnement électromagnétique à une fréquence déterminée par le rapport gyromagnétique du noyau ciblé, ce qui permet de déterminer par spectroscopie la concentration spatiale de ce noyau — typiquement dans le domaine des radiofréquences pour les champs magnétiques ne dépassant pas 20 T.
Énergie de liaison nucléaire
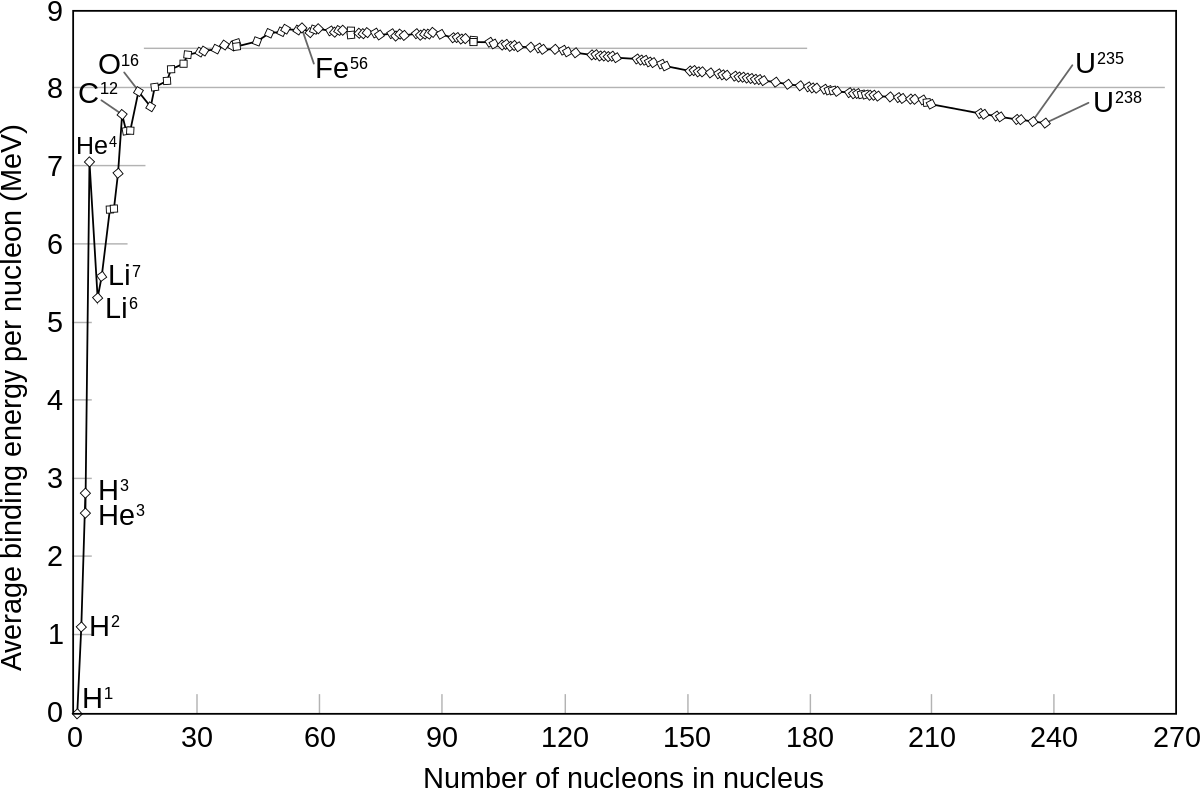
La liaison nucléaire est généralement décrite comme une manifestation résiduelle entre nucléons de l'interaction nucléaire forte qui maintient ensemble les quarks constituant les nucléons. L'énergie de liaison nucléaire est définie comme l'énergie nécessaire pour arracher un nucléon quelconque au noyau considéré. Elle est de l'ordre de quelques mégaélectron-volts par nucléon, partant de 0 (par définition) pour le protium 1H pour atteindre 7,57 MeV/A avec l'uranium 238 en passant par un maximum à 8,795 MeV/A pour le nickel 62. Cette propriété fondamentale explique pourquoi ce sont uniquement les atomes légers qui libèrent de l'énergie par fusion nucléaire tandis que ce sont uniquement les atomes lourds qui libèrent de l'énergie par fission nucléaire :
- La fusion nucléaire survient lorsque des nucléons ou des noyaux atomiques s'assemblent pour former un noyau atomique plus gros. Si l'énergie de liaison nucléaire par nucléon est plus élevée dans le nouveau noyau, il y a libération d'énergie : c'est le cas dans les étoiles jusqu'au nickel 56, au niveau duquel s'arrête la nucléosynthèse stellaire ; le 56Ni étant instable, il se désintègre en fer 56, qui est stable. La nucléosynthèse ne se poursuit pas au-delà du nickel car le nucléide qui serait alors formé, le 60Zn, a une énergie de liaison nucléaire par nucléon inférieure à celle du 56Ni, et sa formation consommerait de l'énergie au lieu d'en libérer : c'est essentiellement à la toute fin de vie des étoiles, même de taille modeste, et particulièrement lors de l'explosion en supernovae des grosses étoiles, que les élements plus lourds que le fer et le nickel sont formés.
- La fission nucléaire n'est autre que l'éclatement d'un noyau atomique en au moins deux morceaux plus petits, avec libération de neutrons (car les noyaux légers sont proportionnellement moins riches en neutrons que les noyaux lourds). Si l'énergie de liaison nucléaire par nucléon est plus faible dans le noyau initial que dans les produits de fission alors il y a libération d'énergie : c'est le cas pour les noyaux plus massifs que ceux du nickel 62 ; l'uranium et le plutonium, par exemple, sont dans ce cas.
Stabilité nucléaire
La physique des noyaux atomiques est gouvernée par les trois interactions fondamentales du modèle standard de la physique des particules : l'interaction forte, l'interaction faible et l'l'interaction électromagnétique. Chaque noyau atomique est défini par le nombre de protons et de neutrons qu'il contient, ainsi que par son énergie totale, l'ensemble définissant les différents « arrangements » des particules selon lesquels l'énergie totale du système peut être distribuée. Plus il y a d'arrangements possibles et plus le système est stable : l'état présentant le plus grand nombre d'arrangements possibles est appelé état fondamental ; c'est celui vers lequel tendent tous les autres états de ce système.
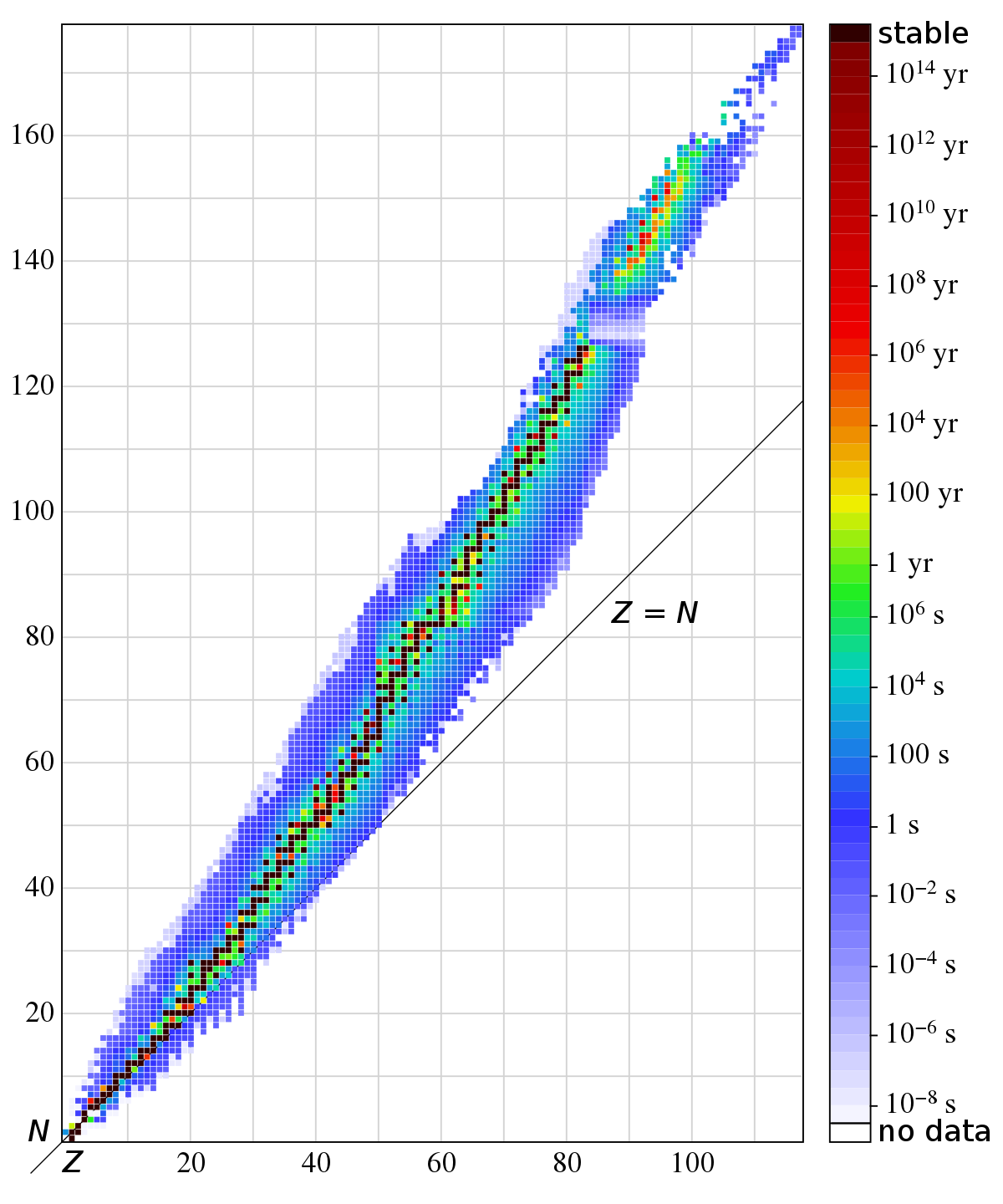
Toute transition d'un état du système vers un autre requiert une énergie d'activation, fournie, dans le cas des noyaux atomiques, par les fluctuations du vide quantique. Lorsque de telles fluctuations suffisent à faire basculer un noyau atomique d'un état donné vers un état d'énergie inférieure, ce noyau est dit instable : on a affaire à un radionucléide. Jusqu'au calcium (Z = 20), les éléments chimiques ont des isotopes stables pour lesquels le nombre N de neutrons est à peu près égal au nombre Z de protons, tandis qu'au-delà de Z = 20 le ratio N/Z tend vers 3/2. Les isotopes instables, appelé radioisotopes, connaissent une désintégration radioactive qui leur permet de se rapprocher d'un état de plus grande stabilité.
Radioactivité
La radioactivité désigne l'ensemble des phénomènes physiques par lesquels un nucléide instable réorganise sa structure nucléaire afin de gagner en stabilité. Ces phénomènes de désintégration radioactive peuvent être les suivants :
-
- Désintégration α : le noyau atomique émet une particule α 4He pour s'alléger et, notamment, réduire son numéro atomique (et donc sa charge électrique). Ceci concerne surtout les noyaux lourds.
-
- Désintégration β : il en existe plusieurs variantes, la principale étant l'émission d'un électron et d'un antineutrino électronique par un neutron converti en proton sous l'effet de l'interaction faible (désintégration β-) ; ceci concerne les noyaux riches en neutrons. La réaction inverse est également possible : émission d'un positon et d'un neutrino électronique par un proton converti en neutron (désintégration β+) ; ceci concerne les noyaux riches en protons. La capture électronique est une autre forme de désintégration β+, qui survient lorsqu'un électron interagit avec un proton du noyau pour former un neutron avec émission d'un neutrino électronique ; le noyau résultant se trouve alors dans un état excité. Les phénomènes de double désintégration β (le 48Ca donnant du 48Ti) et double capture électronique (le 78Kr donnant du 78Se par exemple) sont particulièrement rares, car ils impliquent respectivement deux neutrons et deux protons simultanément.
-
- Émission γ : le noyau atomique se trouve dans un état excité, un ou plusieurs de ses nucléons occupant des niveaux d'énergie supérieurs à ceux de l'état fondamental : un ou plusieurs photons γ sont émis au cours de la relaxation du noyau. Ceci est observé notamment lors d'une transition isomérique (le 99mTc donnant du 99Tc, par exemple).
-
- Fission spontanée : un gros noyau atomique « explose » en au moins deux fragments plus petits, avec émission de neutrons. Ce type de désintégration est observé notamment lorsque le ratio Z2/A est au moins égal à 45 (c'est par exemple le cas du 252Cf).
-
- Radioactivité de clusters : il s'agit d'un mode de désintégration toujours marginal, ayant un rapport de branchement de l'ordre de 10-10 (avec l'exception notable du 114Ba émettant du 12C), consistant en l'émission de noyaux atomiques de petite taille mais plus gros qu'une particule α.
-
- Conversion interne : un isomère nucléaire retombe à son état fondamental en transférant son énergie d'excitation à un électron de son nuage électronique en vertu de la probabilité non nulle qu'un tel électron se trouve dans le noyau.
Chaque radioisotope est caractérisé par une période radioactive, qui correspond au temps nécessaire pour que la moitié des atomes de cet isotope se soit désintégrée. Un même nucléide peut connaître plusieurs modes de désintégration, la proportion relative de chacun de ces modes étant appelée rapport de branchement.
Îlot de stabilité
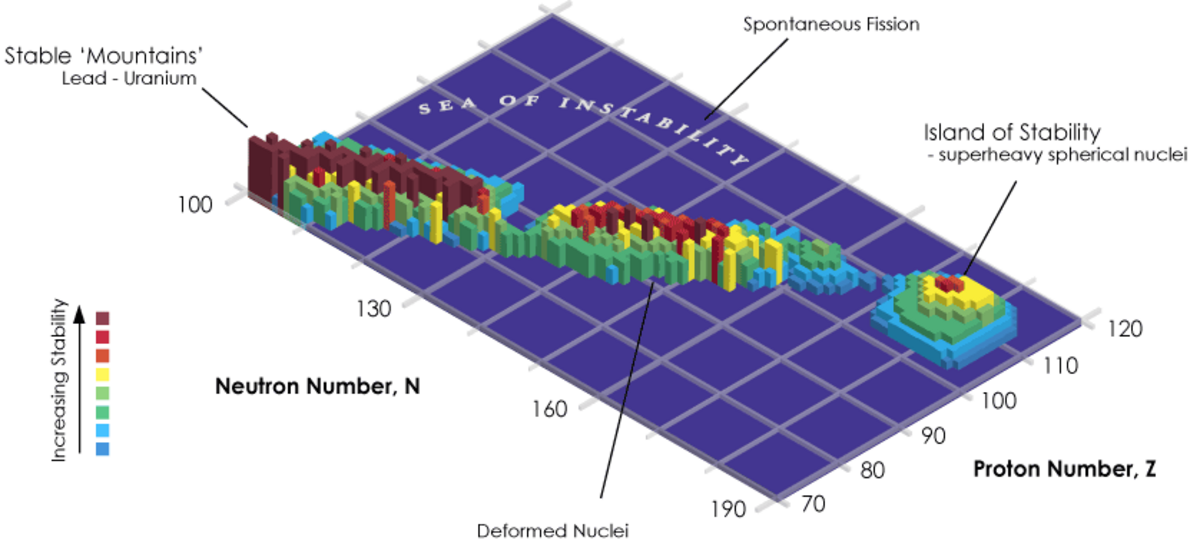
Certaines théories extrapolent les résultats du modèle en couches et les propriétés des nombres magiques en prédisant l'existence d'un îlot de stabilité parmi les nucléides superlourds, pour un nombre magique de 184 neutrons et — selon les théories et les modèles — 114, 120, 122 ou 126 protons. Une approche plus moderne de la stabilité nucléaire montre toutefois, par des calculs fondés sur l'effet tunnel, que, si de tels noyaux superlourds doublement magiques seraient probablement stables du point de vue de la fission spontanée, ils devraient cependant connaître des désintégrations α avec une période radioactive de quelques microsecondes. Un îlot de relative stabilité pourrait néanmoins exister autour du darmstadtium 293, correspondant aux nucléides définis par Z compris entre 104 et 116, et N compris entre 176 et 186 : ces éléments pourraient avoir des isotopes présentant des périodes radioactives atteignant quelques minutes.
Limite à la taille des noyaux
Le plus lourd des nucléides synthétisés jusqu'à présent est l'isotope 294118 et les recherches se poursuivent au GSI afin de produire l'isotope 302120. On ignore précisément jusqu'à combien de nucléons un noyau atomique peut contenir : on estime habituellement la limite d'observabilité expérimentale à environ Z ≈ 130 et la limite théorique à Z = 173 : un 174ème proton (ou neutron) conférerait à la couche nucléaire 1s1/2 une énergie de – 511 keV, égale à la masse au repos d'un électron ou d'un positron ; un tel noyau serait donc instable par rapport à la désintégration β.
Nuage électronique
Si les propriétés nucléaires de l'atome (masse, énergie nucléaire, radioactivité...) relèvent de la physique, et particulièrement de la physique nucléaire et de la physique des particules, les propriétés des nuages électroniques des atomes (taille, énergie d'ionisation, conductivité électrique, valence...) relèvent essentiellement de la chimie et de la science des matériaux.
Taille des atomes
Le nuage électronique d'un atome n'a pas de dimensions bien définies car il consiste en une superposition d'orbitales atomiques de nature probabiliste. Il n'existe donc pas de définition unique ni de mesure définitive de la taille des atomes : celle-ci est généralement définie en termes de distance moyenne entre noyaux d'atomes liés entre eux, mais cette distance varie en fonction de la nature chimique des atomes environnants, du nombre et de la géométrie des liaisons dans lesquelles l'atome est engagé, ou encore de la nature de ces liaisons (métallique, covalente, ionique...). Une valeur théorique de l'extension des orbitales atomiques peut néanmoins être calculée pour chaque noyau atomique, ce qui donne une valeur en excès par rapport aux méthodes empiriques fondées sur la géométrie des mailles cristallines, ou aux mesures effectuées sur des molécules :
| H 53 | He 31 | |||||||||||||||||
| Li 167 | Be 112 | B 87 | C 67 | N 56 | O 48 | F 42 | Ne 38 | |||||||||||
| Na 190 | Mg 145 | Al 118 | Si 111 | P 98 | S 88 | Cl 79 | Ar 71 | |||||||||||
| K 243 | Ca 194 | Sc 184 | Ti 176 | V 171 | Cr 166 | Mn 161 | Fe 156 | Co 152 | Ni 149 | Cu 145 | Zn 142 | Ga 136 | Ge 125 | As 114 | Se 103 | Br 94 | Kr 88 | |
| Rb 265 | Sr 219 | Y 212 | Zr 206 | Nb 198 | Mo 190 | Tc 183 | Ru 178 | Rh 173 | Pd 169 | Ag 165 | Cd 161 | In 156 | Sn 145 | Sb 133 | Te 123 | I 115 | Xe 108 | |
| Cs 298 | Ba 253 | * | Lu 217 | Hf 208 | Ta 200 | W 193 | Re 188 | Os 185 | Ir 180 | Pt 177 | Au 174 | Hg 171 | Tl 156 | Pb 154 | Bi 143 | Po 135 | At n.d. | Rn 120 |
| Fr n.d. | Ra n.d. | * | Lw n.d. | Rf n.d. | Db n.d. | Sg n.d. | Bh n.d. | Hs n.d. | Mt n.d. | Ds n.d. | Rg n.d. | Cn n.d. | Uut n.d. | Uuq n.d. | Uup n.d. | Uuh n.d. | Uus n.d. | Uuo n.d. |
| ↓ | ||||||||||||||||||
| * | La n.d. | Ce n.d. | Pr n.d. | Nd n.d. | Pm n.d. | Sm n.d. | Eu n.d. | Gd n.d. | Tb n.d. | Dy n.d. | Ho n.d. | Er n.d. | Tm n.d. | Yb n.d. | ||||
| * | Ac n.d. | Th n.d. | Pa n.d. | U n.d. | Np n.d. | Pu n.d. | Am n.d. | Cm n.d. | Bk n.d. | Cf n.d. | Es n.d. | Fm n.d. | Md n.d. | Nb n.d. | ||||
| Tableau périodique des éléments indiquant leur rayon atomique théorique en picomètres | ||||||||||||||||||
Au-delà des valeurs numériques, qui ne doivent être vues ici que comme indicatives, ce tableau permet d'illustrer deux tendances :
- En descendant le long d'un groupe du tableau périodique des éléments, la taille des atomes augmente en raison de l'occupation d'orbitales atomiques de nombre quantique principal n croissant, qui correspond à des électrons de moins au moins liés au noyau et donc de plus en plus étendues spatialement.
- En parcourant une période (ligne du tableau) de gauche à droite, la taille des atomes diminue en raison de l'attraction croissante du noyau atomique, de plus en plus chargé positivement, qui limite l'extension spatiale des orbitales atomiques, chargées négativement, en les rapprochant du noyau.
La contraction des lanthanides illustre bien ce dernier phénomène, et est à l'origine du fait que les atomes des métaux de transition des cinquième et sixième périodes ont des tailles à peu près égales : à peine deux picomètres de plus pour le hafnium et le tantale que pour le zirconium et le niobium ; il s'ensuit une augmentation sensible de la masse volumique des métaux correspondants, par exemple 6,5 et 13,3 g/cm3 respectivement pour le zirconium et le hafnium — soit plus qu'un doublement.
Liaisons chimiques
- noir ou anthracite pour le carbone
- bleu pour l'azote
- rouge pour l'oxygène
- blanc ou gris clair pour l'hydrogène.
L'une des propriétés les plus remarquables des atomes est leur propension à former toute une variété de liaisons chimiques avec d'autres atomes, afin de constituer des édifices moléculaires, des cristaux, voire des agrégats atomiques (clusters, « superatomes »). Ces liaisons résultent du recouvrement d'orbitales atomiques appartenant à deux atomes pour former une orbitale moléculaire occupée par deux électrons provenant chacun d'un des deux atomes engagés dans la liaison (on parle dans ce cas de liaison covalente), mais peuvent aussi provenir de l'attraction électrostatique entre atomes de charge électrique opposée (un cation positif et un anion négatif : on parle alors de liaison ionique).
La réactivité chimique des atomes dépend du nombre d'électrons qu'ils possèdent dans leurs sous-couches électroniques périphériques (sous-couches s et p) — les électrons de valence. En vertu de la règle de l'octet, chaque atome tend en effet à atteindre un état où ses sous-couches s et p périphériques sont saturées d'électrons : deux électrons dans la sous-couche s et six électrons dans la sous-couche p. Par exemple, l'hydrogène n'a qu'un unique électron dans sa sous-couche 1s, de sorte qu'il s'associe avec un autre atome pour acquérir le second électron qu'il manque à cette sous-couche pour être saturée : on dit que l'hydrogène est monovalent. L'oxygène, lui, a quatre électrons dans sa sous-couche 2p, et s'associe donc avec deux autres atomes pour acquérir les deux électrons qui manquent à cette sous-couche pour être saturée : l'oxygène est donc divalent. Le carbone, ayant deux électrons dans sa sous-couche 2p, est tétravalent. Les gaz rares les plus légers tels que l'hélium et le néon, avec respectivement deux électrons dans la sous-couche 1s et six électrons dans la sous-couche 2p, sont à peu près inertes chimiquement car leur configuration électronique est déjà saturée d'électrons de valence — mais il existe une chimie des gaz rares concernant les gaz rares plus lourds, qui présentent une réactivité chimique non nulle en raison de l'écrantage du noyau par les électrons de cœur qui rend les électrons périphériques plus mobilisables.
La liaison covalente est une liaison forte : celle qui unit les deux atomes d'iode de la molécule I2 n'est que de 151 kJ/mol, mais atteint 436 kJ/mol pour la molécule H2, 498 kJ/mol pour O2, et 945 kJ/mol pour N2.
Un autre type de liaison chimique s'observe dans les métaux : la liaison métallique. Les atomes métalliques ont en effet la propriété, lorsqu'ils s'assemblent, de faire apparaître, par recouvrement de leurs orbitales atomiques périphériques, une « bande de conduction » qui peut être occupée par des électrons délocalisés (on parle « d'aromaticité métallique ») issus des orbitales les moins liées de ces atomes ; la conductivité électrique des métaux résulte du fait qu'il existe un nombre bien plus élevé de configurations électroniques possibles (on parle de densité d'états électroniques) qu'il y a d'électrons dans cette bande de conduction, de sorte que ces derniers y constituent un « gaz d'électrons ».
Des atomes appartenant à des molécules distinctes peuvent également interagir avec leur nuage électronique autrement que par liaison covalente ou ionique. Ainsi, un atome d'halogène déficitaire en électrons et facilement polarisable peut former une liaison halogène avec les atomes ou groupements fonctionnels riches en électrons, tels que des dérivés oxygénés ou azotés. De même, une molécule ayant un atome d'hydrogène acide peut former une liaison faible (de 5 à 20 kJ/mol) avec un atome électronégatif ayant des doublets non liants. Enfin, l'interaction des moments dipôlaires de deux atomes est à l'origine de la force de van der Waals, dont la force est du même ordre de grandeur que celle de la liaison hydrogène.
Électronégativité et affinité électronique
Compte tenu de leur configuration électronique, certains atomes auront davantage tendance que d'autres à attirer des électrons en formant des liaisons chimiques covalentes. Cette propriété est appelée l'électronégativité d'un atome. Elle dépend en premier lieu de leur nombre de masse et, corrélativement, de l'intensité de la liaison entre le noyau atomique et des électrons de valence. Elle est généralement évaluée à l'aide de l'échelle de Pauling, du nom de Linus Pauling qui la mit au point en 1932. D'autres méthodes d'évaluation donnent des résultats légèrement différents, mais toutes révèlent les mêmes tendances à travers le tableau périodique.
| H 2,20 | He n.d. | |||||||||||||||||
| Li 0,98 | Be 1,57 | B 2,04 | C 2,55 | N 3,04 | O 3,44 | F 3,98 | Ne n.d. | |||||||||||
| Na 0,93 | Mg 1,31 | Al 1,61 | Si 1,90 | P 2,19 | S 2,58 | Cl 3,16 | Ar n.d. | |||||||||||
| K 0,82 | Ca 1,00 | Sc 1,36 | Ti 1,54 | V 1,63 | Cr 1,66 | Mn 1,55 | Fe 1,83 | Co 1,88 | Ni 1,91 | Cu 1,90 | Zn 1,65 | Ga 1,81 | Ge 2,01 | As 2,18 | Se 2,55 | Br 2,96 | Kr 3,0 | |
| Rb 0,82 | Sr 0,95 | Y 1,22 | Zr 1,33 | Nb 1,6 | Mo 2,16 | Tc 1,9 | Ru 2,2 | Rh 2,28 | Pd 2,20 | Ag 1,93 | Cd 1,69 | In 1,78 | Sn 1,96 | Sb 2,05 | Te 2,1 | I 2,66 | Xe 2,6 | |
| Cs 0,79 | Ba 0,89 | * | Lu 1,27 | Hf 1,3 | Ta 1,5 | W 2,36 | Re 1,9 | Os 2,2 | Ir 2,20 | Pt 2,28 | Au 2,54 | Hg 2,0 | Tl 1,62 | Pb 2,33 | Bi 2,02 | Po 2,0 | At 2,2 | Rn 2,2 |
| Fr 0,7 | Ra 0,9 | * | Lw 1,3 | Rf n.d. | Db n.d. | Sg n.d. | Bh n.d. | Hs n.d. | Mt n.d. | Ds n.d. | Rg n.d. | Cn n.d. | Uut n.d. | Uuq n.d. | Uup n.d. | Uuh n.d. | Uus n.d. | Uuo n.d. |
| ↓ | ||||||||||||||||||
| * | La 1,1 | Ce 1,12 | Pr 1,13 | Nd 1,14 | Pm 1,13 | Sm 1,17 | Eu 1,2 | Gd 1,2 | Tb 1,1 | Dy 1,22 | Ho 1,23 | Er 1,24 | Tm 1,25 | Yb 1,1 | ||||
| * | Ac 1,1 | Th 1,3 | Pa 1,5 | U 1,38 | Np 1,26 | Pu 1,28 | Am 1,13 | Cm 1,28 | Bk 1,3 | Cf 1,3 | Es 1,3 | Fm 1,3 | Md 1,3 | Nb 1,3 | ||||
| Tableau périodique des éléments indiquant leur électronégativité selon l'échelle de Pauling | ||||||||||||||||||
La lecture de ce tableau permet de dégager deux tendances principales :
- Lorsqu'on parcourt de haut en bas une colonne du tableau, l'électronégativité diminue car les électrons de valence sont séparés du noyau par un nombre croissant de sous-couches électroniques et sont donc de moins en moins liés à lui, d'où une affinité d'intensité décroissante.
- Lorsqu'on parcourt de gauche à droite une période du tableau, l'électronégativité est minimale à gauche et maximale à droite ; cela provient du fait que les alcalins ont plutôt tendance à perdre un électron qu'à en gagner pour acquérir la configuration électronique d'un gaz rare, tandis que les halogènes ont fortement tendance à gagner un électron pour saturer leur sous-couche p et acquérir la configuration électronique d'un gaz rare.
Le cas des gaz rares eux-mêmes est particulier car les plus légers d'entre eux sont chimiquement inertes, une véritable chimie des gaz rares n'existant que pour le krypton et, surtout, le xénon — le radon est trop radioactif pour présenter une chimie significative.
L'électronégativité n'est pas une notion atomique absolue, mais plutôt une propriété chimique relative aux atomes engagés dans une liaison avec d'autres atomes. La propriété atomique stricto sensu correspondant à l'électronégativité est appelée affinité électronique et correspond à l'énergie libérée par l'adjonction d'un électron à un atome neutre pour former un anion. Il s'agit donc d'une grandeur physique mesurable, contrairement à l'électronégativité.
| H 73 | He * | |||||||||||||||||
| Li 60 | Be * | B 27 | C 122 | N * | O 141 | F 328 | Ne * | |||||||||||
| Na 53 | Mg * | Al 42 | Si 134 | P 72 | S 200 | Cl 349 | Ar * | |||||||||||
| K 48 | Ca 2 | Sc 18 | Ti 8 | V 51 | Cr 65 | Mn * | Fe 15 | Co 64 | Ni 112 | Cu 119 | Zn * | Ga 41 | Ge 119 | As 79 | Se 195 | Br 324 | Kr * | |
| Rb 47 | Sr 5 | Y 30 | Zr 41 | Nb 86 | Mo 72 | Tc * | Ru 101 | Rh 110 | Pd 56 | Ag 126 | Cd * | In 39 | Sn 107 | Sb 101 | Te 190 | I 295 | Xe * | |
| Cs 46 | Ba 14 | * | Lu 33 | Hf n.d. | Ta 31 | W 79 | Re * | Os 104 | Ir 150 | Pt 205 | Au 223 | Hg * | Tl 36 | Pb 35 | Bi 91 | Po n.d. | At n.d. | Rn * |
| Fr n.d. | Ra n.d. | * | Lw n.d. | Rf n.d. | Db n.d. | Sg n.d. | Bh n.d. | Hs n.d. | Mt n.d. | Ds n.d. | Rg n.d. | Cn n.d. | Uut n.d. | Uuq n.d. | Uup n.d. | Uuh n.d. | Uus n.d. | Uuo n.d. |
| ↓ | ||||||||||||||||||
| * | La 45 | Ce 92 | Pr n.d. | Nd n.d. | Pm n.d. | Sm n.d. | Eu n.d. | Gd n.d. | Tb n.d. | Dy n.d. | Ho n.d. | Er n.d. | Tm 99 | Yb n.d. | ||||
| * | Ac n.d. | Th n.d. | Pa n.d. | U n.d. | Np n.d. | Pu n.d. | Am n.d. | Cm n.d. | Bk n.d. | Cf n.d. | Es n.d. | Fm n.d. | Md n.d. | Nb n.d. | ||||
| Tableau périodique des éléments indiquant leur affinité électronique en kJ/mol. | ||||||||||||||||||
Les valeurs représentées par un astérisque dans le tableau ci-dessus sont voisines de zéro d'après l'interprétation quantique de la configuration électronique des atomes correspondants. On note que l'affinité électronique ne présente pas la périodicité régulière de l'électronégativité, mais qu'elle est tout de même la plus élevée pour les halogènes et sensiblement plus faible pour les métaux alcalins et, surtout, alcalino-terreux.
Magnétisme

Comme les nucléons, les électrons possèdent un spin, analogue à un moment angulaire, intrinsèque à chaque électron, auquel se superpose un moment angulaire orbital, représenté par le nombre quantique secondaire, généré par la distribution probabiliste de l'électron dans son orbitale atomique, qui s'assimile à un « mouvement ». Ces deux moments angulaires se combinent pour constituer un champ magnétique autour de l'atome. Lorsque deux électrons occupent une case quantique de l'atome, ils ont chacun un spin opposé en vertu du principe d'exclusion de Pauli, ce qui annule le moment angulaire résultant ; mais les atomes et les ions qui ont un nombre impair d'électrons ont par conséquent un moment magnétique résultant non nul provenant du spin de leurs électrons.
Les matériaux ferromagnétiques ont la particularité d'orienter dans la même direction les moments magnétiques de leurs atomes par interaction d'échange, ce qui génère un champ magnétique macroscopique : c'est le cas, par exemple, de la magnétite Fe3O4. Certains matériaux orientent au contraire les moments magnétiques de leur atomes dans des directions alternativement opposées, ce qu'on appelle « antiferromagnétisme ».
Les matériaux paramagnétiques révèlent leur magnétisme intrinsèque uniquement sous l'effet d'un champ magnétique extérieur, qui aligne le moment magnétique de leurs atomes tant qu'il est présent (susceptibilité magnétique positive) ; dès que ce champ magnétique extérieur cesse d'être appliqué, la magnétisation d'un matériau paramagnétique disparaît. Les atomes ayant des électrons non appariés dans leurs sous-couches d et f ont des propriétés magnétiques intenses car ces électrons sont fortement localisés ; en particulier, les lanthanides font des aimants particulièrement puissants en raison de leur moment magnétique induit par jusqu'à sept électrons non appariés — notamment le néodyme et le samarium. Il existe une méthode d'analyse spectroscopique sous champ magnétique analogue à la résonance magnétique nucléaire (RMN) qui fait intervenir le spin des électrons au lieu de celui des noyaux : la résonance paramagnétique électronique (également appelée de façon plus propre « résonance de spin électronique »).
Le diamagnétisme, quant à lui, est un phénomène assez général dû au moment angulaire orbital des électrons et non au spin de ces derniers, qui consiste en l'apparition d'un champ magnétique de direction opposée à tout champ magnétique extérieur ; c'est un phénomène généralement de faible intensité, hormis quelques cas particuliers tels que, par exemple, l'or, le mercure, le bismuth et surtout les matériaux supraconducteurs (effet Meissner).
Fluorescence et phosphorescence
Un électron d'un atome peut être excité par absorption d'un photon incident, ce qui le fait occuper une orbitale atomique d'énergie supérieure à celle de son état fondamental. De nombreuses molécules aromatiques ou présentant des liaisons π conjuguées sont susceptibles d'être ainsi excitées simplement par éclairage ; leur relaxation vers l'état fondamental se traduit alors par l'émission d'un ou plusieurs photons, selon deux mécanismes distincts :

- La fluorescence consiste en l'émission, par un atome excité, d'un photon d'énergie inférieure au photon incident et correspondant exactement à la différence d'énergie entre l'état excité de l'électron et son état fondamental. Il s'agit par conséquent d'un phénomène quasi instantané, la durée de vie de l'état excité des matériaux usuellement employés pour leurs propriétés fluorescentes étant de l'ordre de 0,5 à 20 ns : la fluorescence cesse donc dès que l'éclairage cesse. La longueur d'onde émise est supérieure à celle de la lumière absorbée, ce qui permet par exemple d'obtenir des effets esthétiquement intéressants par éclairage ultraviolet de matériaux fluorescents émettant dans le spectre visible.
- La phosphorescence diffère de la fluorescence en ce que la relaxation fait intervenir un état triplet entre les deux états singulets que sont l'état excité et l'état fondamental. Un électron excité dans un état singulet peut passer facilement dans un état triplet par conversion intersystème, mais s'y trouve alors « piégé » car il ne peut rejoindre l'état fondamental singulet qu'à travers des transitions « interdites » ; ces dernières sont néanmoins possibles du point de vue quantique, notamment grâce à des couplages spin-orbite, mais demeurent cinétiquement très défavorisées, ce qui explique que la phosphorescence soit un phénomène pouvant persister pendant, parfois, plusieurs heures.
Raies spectrales
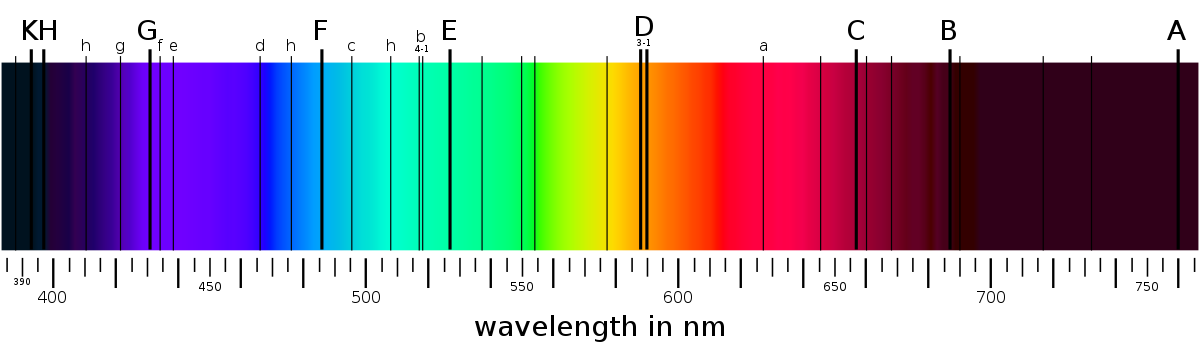
L'interaction d'atomes avec un rayonnement électromagnétique peut également se traduire par l'apparition de raies d'absorption ou d'émission à certaines longueurs d'onde particulières sur un spectre par ailleurs continu. Ces longueurs d'onde correspondent à l'énergie de transition entre couches électroniques et sous-couches électroniques : lorsqu'un atome est atteint par un photon ayant une énergie égale à l'une de ces transitions entre niveaux d'énergie électroniques, un électron peut absorber ce photon et passer à un niveau d'énergie supérieur, laissant une longueur d'onde déficitaire en photons, ce qui se matérialise dans le spectre par une raie d'absorption.
Chaque atome, chaque ion, et même chaque molécule ou radical libre, possède ainsi une signature spectrale caractéristique, très employée par exemple en astrophysique pour détecter leur présence et déterminer leur concentration dans le milieu interstellaire, voire l'espace intergalactique : la disposition des raies spectrales, leur éventuel décalage (décalage vers le rouge), leur largeur, leur netteté et leur éventuelle séparation en plusieurs composantes (ce qu'on appelle leur structure fine) sont ainsi des paramètres riches d'informations sur le milieu traversé par le rayonnement analysé entre sa source et sa détection par les instruments de spectroscopie.
- La présence d'un champ magnétique dans le milieu analysé peut être détectée par effet Zeeman, qui scinde une raie spectrale unique en trois composantes ou davantage, en raison de l'interaction du champ magnétique ambiant avec le moment magnétique de spin des électrons de l'atome : si plusieurs configurations électroniques partagent le même niveau d'énergie en l'absence de champ magnétique, cela cesse d'être le cas lorsqu'un champ magnétique est appliqué et chacune de ces configurations électroniques acquiert un niveau d'énergie légèrement différent des autres, leur multiplicité devenant alors visible sur le spectre d'absorption.
- La présence d'un champ électrique peut être détectée dans le spectre de la même façon, cette fois en raison de l'effet Stark.
- La vitesse radiale du milieu étudié par rapport à l'observateur peut être déterminée par le décalage des raies spectrales vers le rouge (éloignement) ou vers le bleu (rapprochement) par effet Doppler-Fizeau : c'est un résultat très utile en astronomie pour évaluer la distance d'un objet à partir de son « redshift » en appliquant la loi de Hubble.
États de la matière

La matière baryonique peut exister à l'état solide, liquide ou gazeux selon sa température et sa pression : les transitions entre ces états surviennent à des niveaux de température et de pression directement en rapport avec les propriétés des atomes et de leurs arrangements moléculaires qui constituent chaque matériau. Les états solide et liquide sont qualifiés d’états condensés, tandis que les états liquide et gazeux sont qualifiés d’états fluides. Les cristaux liquides (une mésophase) sont un état intermédiaire entre solide et liquide.
Il existe par ailleurs des états de la matière moins courants sur Terre et qui dérivent des précédents :
- Les plasmas sont un gaz d'atomes fortement ionisés dans un gaz d'électrons libres. Ce sont donc des milieux conducteurs. Il s'agit de l'état de la matière de loin le plus courant dans l'univers : les étoiles sont entièrement à l'état de plasma, le milieu interplanétaire du système solaire est balayé par le vent solaire, qui est un plasma, et des plasmas constituent l'essentiel du milieu interstellaire et de l'espace intergalactique. Sur Terre, les éclairs sont également des plasmas, de même que les aurores polaires.
- Les condensats de Bose-Einstein sont des gaz de bosons (les atomes sont aussi des bosons) piégés dans un puits de potentiel et refroidis à une température très proche du zéro absolu : dans ces conditions, une grande partie des bosons occupe l'état quantique de plus faible énergie dans le puits de potentiel, de sorte que leurs fonctions d'onde se recouvrent au point de révéler à l'échelle macroscopique des effets quantiques ponctuels (à l'échelle de l'atome) inobservables à température plus élevée.
- Les supersolides seraient un état non confirmé de la matière aux atomes ordonnés comme un cristal mais dont les lacunes se comporteraient comme un condensat de Bose-Einstein superfluide.