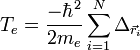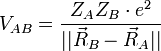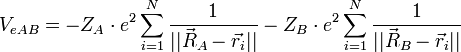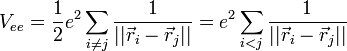Approximation de Born-Oppenheimer - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En chimie quantique, le calcul des niveaux d'énergie et des fonctions d'onde d'une molécule (même de taille modeste) est une tâche extrêmement lourde. L'approximation de Born-Oppenheimer (BO) permet de la soulager grandement. Cette méthode a été publiée en 1927 par Born et Oppenheimer et est toujours utilisée en chimie quantique.
L'hypothèse de Born et Oppenheimer peut s'exprimer ainsi : on considère que l'on peut découpler le mouvement des électrons de celui des noyaux, en estimant que leur mouvement est beaucoup plus lent que celui des électrons : on les considère comme fixes dans l'étude du mouvement des électrons de la molécule. On traite alors les distances internucléaires comme des paramètres. Elle a une conséquence calculatoire immédiate, qu'on appelle hypothèse adiabatique. Il s'agit en fait de la même approximation.
Pour fixer le contexte de cette méthode, considérons l'interaction coulombienne d'un proton et d'un électron. Ce problème est celui de l'atome d'hydrogène. On peut toujours ramener l'étude du mouvement de deux corps (formant un système isolé) dans le référentiel du laboratoire à celui d'un seul corps, dit "mobile fictif", dans le référentiel du centre de masse, centre de masse en translation rectiligne uniforme dans le laboratoire. Le centre de masse est ici pratiquement confondu avec le proton puisque la masse d'un proton (mp de l'ordre de 1,67.10 − 27 kg) est environ 1800 fois plus grande que celle de l'électron (me de l'ordre de 9,31.10 − 31 kg). Par ailleurs, la masse µ du mobile fictif est pratiquement celle de l'électron :
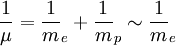
L'idée de l'approximation BO est inspirée de cette étude, à cette différence importante près que le problème de l'atome d'hydrogène est un problème à deux corps, analytiquement exactement soluble, alors que celui d'une molécule est un problème à au moins trois corps, insoluble analytiquement sans approximations. Même la molécule la plus simple qui soit, l'ion moléculaire
(*) : le fait de considérer µ comme étant pratiquement la masse de l'électron et le centre de masse comme étant pratiquement confondu avec le proton, n'est pas nécessaire à la résolution exacte. Ce sont des approximations numériques qui n'affectent pas le principe de la résolution. Le point important, qui permet, en pratique, l'étude exacte de l'atome d'hydrogène est la possibilité de ramener un problème à 2 corps à un problème à un corps.
Application à une molécule diatomique
Principe
On peut résumer les deux étapes de la méthode pour une molécule diatomique, dont les noyaux, qui sont considérés comme ponctuels vis-à-vis de l'étendue du mouvement des électrons, sont distants d'un longueur R :
1) On étudie d'abord le mouvement des électrons dans une configuration nucléaire donnée, où la distance internucléaire R est considérée comme fixe (il est équivalent de dire que les deux noyaux sont fixes) ; l'approximation de Born-Oppenheimer consiste à dire que cette hypothèse fournira des solutions correctes, bien que non-exactes. On résout alors l'équation de Schrödinger pour les électrons en traitant R comme un paramètre. On obtient un ensemble d'états propres pour le système électronique, d'énergies Ep(R). Les N électrons de la molécule sont repérés par leur rayon-vecteur
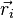
2) On étudie ensuite le mouvement des deux noyaux (rotation et vibration de "l'haltère" formée par les deux noyaux), indépendamment de l'état du système électronique. Un point important est que les énergies Ep(R) trouvées à la première étape apparaîtront comme un terme supplémentaire dans la partie d'énergie potentielle du hamiltonien du système de noyaux. Cette étude ne relève plus directement de l'approximation de Born-Oppenheimer. Il ne faut cependant pas perdre de vue que l'étude de la vibration et de la rotation des molécules se fait dans le contexte préparé par cette approximation. Dans la pratique, tout ce qui est dit sur cette page se résume au fait que l'on étudie par la suite la rotation et la vibration d'une molécule dans un état électronique donné, représenté par une courbe d'énergie potentielle.
Application
Hamiltonien d'une molécule diatomique A-B
On considère une molécules formée de deux atomes, A et B, de masse mA et mB, de numéro atomique ZA et ZB. Ces deux atomes apportent un total de N électrons, chacun de charge -q, repérés par un indice i. On a N = ZA + ZB si la molécule est électriquement neutre. Le calcul mené ci-dessous se place dans ce cas ; par exemple ZA est aussi bien le nombre de protons du noyau de A que son nombre d'électrons. Le hamiltonien doit comporter l'énergie cinétique des noyaux TA et TB, l'énergie cinétique des électrons Te, l'énergie potentielle d'interaction électrostatique des noyaux entre eux VAB, des électrons entre eux Vee, des électrons et des noyaux VeAB. On a donc
où, avec
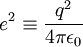
On se place maintenant dans le référentiel du centre de masse G des noyaux, et on prend G pour origine des positions. Remarquons qu'il n'est pas exactement confondu avec le centre de masse de la molécule. L'énergie cinétique des noyaux dans le référentiel du laboratoire est, comme en mécanique classique, la somme de l'énergie cinétique du centre de masse dans ce référentiel et de l'énergie cinétique des noyaux dans le référentiel du centre de masse (RCM). On sait (voir un cours de mécanique classique) que dans le RCM, l'étude du mouvement des deux noyaux peut être ramené à celui du mobile fictif dont la position est donnée par
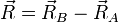
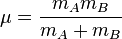
Dans le référentiel du laboratoire :
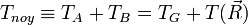
Dans le RCM :
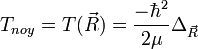
Les autres termes du hamiltonien ne sont pas modifiés dans le RCM, en se rappelant toutefois que les positions sont maintenant repérées par rapport au centre de masse de A et B.
Equation de Schrödinger électronique
L'équation de Schrödinger dont la fonction d'onde totale de la molécule est solution s'écrit
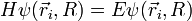
où, d'après BO, les mouvements électronique et nucléaire sont découplés, et au sein du mouvement nucléaire les mouvements de rotation et de vibration le sont également :
E = Eelectronique + Evibration + Erotation
et
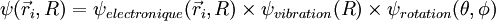
- L'approximation BO stipule que les noyaux sont fixes dans le RCM : Tnoy = 0
Dans le hamiltonien, il ne reste donc plus que des termes électroniques : c'est un hamiltonien dont la solution est la fonction d'onde électronique
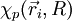
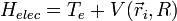
où l'on a rassemblé les termes d'énergie potentielle énumérés ci-dessus dans le terme
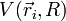
On a donc
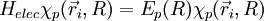
- On suppose que la fonction d'onde totale de la molécule se développe sur la base . Les coefficients du développement sont notés
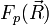
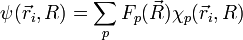
expression que l'on réinjecte dans l'équation de Schrödinger initiale, avant l'hypothèse BO :
![\left[T_{noy}+H_{elec}\right]\sum_p F_p(\vec R)\chi_p(\vec r_i, R)=E\sum_p F_p(\vec R)\chi_p(\vec r_i, R)](https://static.techno-science.net/illustration/Definitions/autres/7/7a2813677a39e2ad5a6202178648ec6d_8bf9d8cb9b9297f91b87d6c8b8cba45c.png)
donc par action de Helec :
![\left[T_{noy}+E_p(R)\right]\sum_p F_p(\vec R)\chi_p(\vec r_i, R)=E\sum_p F_p(\vec R)\chi_p(\vec r_i, R)](https://static.techno-science.net/illustration/Definitions/autres/9/9f3e9408b6f5f32ab3c14867b6462493_275d5c2a37d9fd6566285473076822a4.png)
expression que l'on projette sur une fonction
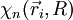
![\sum_p\int d^3r_1 ... d^3r_N \chi_n^*(\vec r_i, R)T_{noy} \left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]+E_n(R)F_n(\vec R)=EF_n(\vec R)](https://static.techno-science.net/illustration/Definitions/autres/f/f18b774dee75da084f6f869920f14b29_876700da7c214f77e35c1d61eeaf317a.png)
puisque la base adiabatique est orthonormée.
- Hypothèse adiabatique
On connaît l'action de
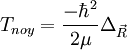
![T_{noy} \left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]=\frac{-\hbar^2}{2\mu}\Delta_{\vec R}\left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]](https://static.techno-science.net/illustration/Definitions/autres/5/5fb4edefbeb4aa3c6f60533419559acb_8a6d0b12c53326459e579d8390ca9c2b.png)
i.e.
![T_{noy} \left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]=\frac{-\hbar^2}{2\mu}\left[ F_p(\vec R)\Delta_{\vec R}\chi_p(\vec r_i, R)+2\vec\nabla_{\vec R}F_p(\vec R)\vec\nabla_{\vec R}\chi_p(\vec r_i, R)+\chi_p(\vec r_i, R)\Delta_{\vec R}F_p(\vec R)\right ]](https://static.techno-science.net/illustration/Definitions/autres/2/20c0a8b11ab8acf135ad043b4f5bb6d7_c3cc9d8fd4c21a8152d95a0d937413d2.png)
L'approximation adiabatique consiste à dire que les variations de la fonction d'onde électronique
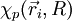
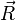
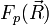
![T_{noy} \left[F_p(\vec R)\chi_p(\vec r_i, R)\right]=\frac{-\hbar^2}{2\mu}\left[\chi_p(\vec r_i, R)\Delta_{\vec R}F_p(\vec R)\right ]](https://static.techno-science.net/illustration/Definitions/autres/2/2859be14c97d5c1cecf7355ad7a6dee6_f2748592a29b9531467d5cc1f5bf88bb.png)
- Réécrivons alors l'expression obtenue après projection sur χn, en tenant compte du calcul précédent :
![\sum_p\int d^3r_1 ... d^3r_N \chi_n^*(\vec r_i, R)\frac{-\hbar^2}{2\mu}\left[\chi_p(\vec r_i, R)\Delta_{\vec R}F_p(\vec R)\right ]+E_n(R)F_n(\vec R)=EF_n(\vec R)](https://static.techno-science.net/illustration/Definitions/autres/2/273a7d653d9ee04a940b113f7ba4c16f_eb23984b8f49eeabe1dd376ae574fb45.png)
et puisque la base adiabatique est orthonormée :
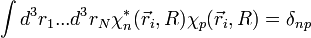
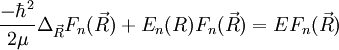
qu'on peut réécrire comme suit :
![\left[\frac{-\hbar^2}{2\mu}\Delta_{\vec R}+E_n(R)\right ]F_n(\vec R)=EF_n(\vec R)](https://static.techno-science.net/illustration/Definitions/autres/f/fb7f236c85dbc38e7516b4a9a7629420_0d2b11b89251a0788c0725d254e07a62.png)
qui apparaît comme l'équation de Schrödinger dont
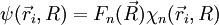
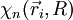
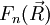
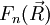
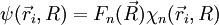
Ainsi, l'approximation adiabatique a permis de ramener un état de la molécule, initialement décrit comme une superposition de fonctions de la base adiabatique, à une seule de ces fonctions.
Equation de Schrödinger nucléaire
Nous amorçons ici l'étude de la rotation et de la vibration de la molécule diatomique. Reprenons la dernière équation ci-dessus. Nous pouvons l'interpréter comme étant l'équation de Schrödinger nucléaire, où le terme d'énergie cinétique est bien celui du mobile fictif correspondant au mouvement relatif des noyaux (c'est l'énergie cinétique totale des noyaux dans le référentiel du centre de masse), et où la valeur propre En(R) du hamiltonien électronique joue le rôle d'une énergie potentielle dans ce hamiltonien nucléaire.
- Cette énergie est une fonction radiale, et les résultats relatifs au mouvement dans un potentiel central, obtenus traditionnellement dans l'étude quantique de l'atome d'hydrogène s'appliquent : on peut développer
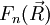
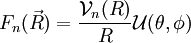
La fonction
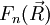
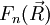
Conclusion
L'énergie totale de la molécule dans le référentiel du centre de masse apparaît in fine comme la somme de l'énergie électronique, de l'énergie de rotation de "l'haltère" formée par les noyaux (rotateur rigide) et de l'énergie de vibration des noyaux (l'image correspondante est celle de "masses ponctuelles reliées par un ressort". En physique nucléaire, on parle aussi d'énergie de rotation et de vibration des noyaux, dans le cadre d'un modèle dit collectif ; le noyau y est considéré comme un objet non ponctuel). On a donc découplage de la rotation des noyaux, de la vibration des noyaux, et du mouvement des électrons. Ce résultat simple et important est la conséquence du l'approximation de Born-Oppenheimer. Ce modèle élémentaire est amélioré en considérant par exemple le couplage de la rotation et de la vibration comme une perturbation au mouvement idéal découplé (distorsion centrifuge).