Anthraquinone - Définition
La liste des auteurs de cet article est disponible ici.
Chimie
Il y a plusieurs moyens d'obtenir de l'anthraquinone :
- L'oxydation de l'anthracene.
- La condensation du benzène avec l'acide phtalique en présence d'AlCl3 (substitution de Friedel et Crafts). Le produit de cette réaction est l'acide o-benzoylbenzoïque, qui subit ensuite une nouvelle condensation, cette fois intramoléculaire, pour former l'anthraquinone.
- Réaction de Diels-Alder (à partir de la naphtoquinone et du 1,3-butadiène), suivie d'une oxydation.
- Réaction de rétro-Diels-Alder.
Dans une réaction chimique classique appelée la synthèse de Bally-Scholl (1905), l'anthraquinone se condense avec le glycérol pour former le benzanthrone. Dans cette réaction la quinone est d'abord réduite par du cuivre dans de l'acide sulfurique (transformant un groupement cétone en un groupement méthylène), puis on ajoute du glycérol.
Écotoxicologie
Sur le plan de l’écotoxicologie, les concentrations létales 50 (CL50) dont l'ordre de grandeur est indiqué ci-après, sont observées :
- CL50 sur poissons : 44 mg·l-1,
- CL50 sur daphnies : > 10 mg·l-1,
- CL50 sur algues : > 10 mg·l-1.
Caractéristiques physico-chimiques
L'anthraquinone est seulement très partiellement soluble dans l'eau, mais est miscible dans l'alcool, le nitrobenzène et l'aniline.Cette substance est chimiquement stable dans des conditions normales.
Les caractéristiques physico-chimiques dont l'ordre de grandeur est indiqué ci-après, influencent les risques de transfert de cette substance active vers les eaux, et le risque de pollution des eaux :
- Hydrolyse à pH 7 : très stable,
- Solubilité : 0,084 mg·l-1,
- Coefficient de partage carbone organique-eau : 3 215 cm3·g-1. Ce paramètre, noté Koc, représente le potentiel de rétention de cette substance active sur la matière organique du sol. La mobilité de la matière active est réduite par son absorption sur les particules du sol.
- Durée de demi-vie : 8 jours. Ce paramètre, noté DT50, représente le potentiel de dégradation de cette substance active, et sa vitesse de dégradation dans le sol.
- Coefficient de partage octanol-eau : 3,52. Ce paramètre, noté log Kow ou log P, mesure l’hydrophilie (valeurs faibles) ou la lipophilie (valeurs fortes) de la substance active.
Applications industrielles
L'anthraquinone est utilisée dans la fabrication de teinture, notamment l'alizarine. Beaucoup de pigments naturels en sont dérivés . Elle est aussi utilisée dans la fabrication industrielle de pâte à papier. Une autre utilisation est celle de répulsif à l'égard des oiseaux pour les plantations.
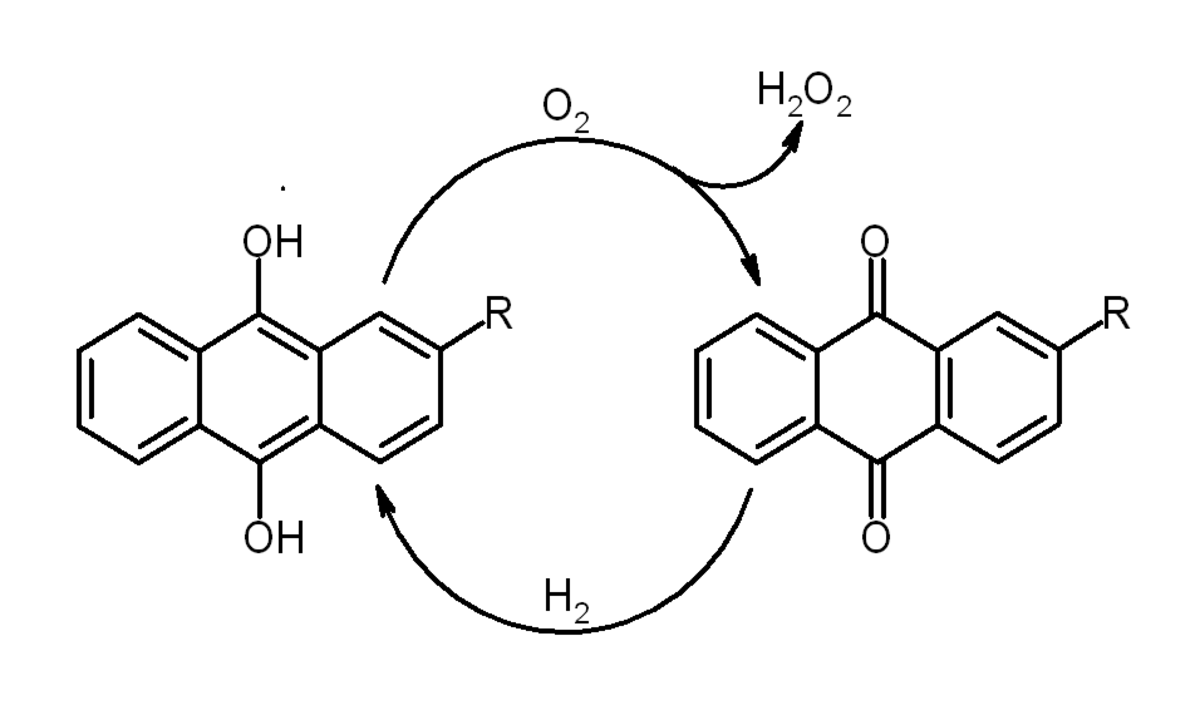
Un dérivé, le 2-éthylanthraquinone, est utilisé pour la fabrication commerciale du peroxyde d'hydrogène :
Applications médicales
L'anthraquinone est utilisée comme laxatif. Une utilisation prolongée ou un abus mène à un mélanisme du côlon , dû à la libération de lipofuscine (présente dans les histiocytes et mastocytes) dans le côlon.