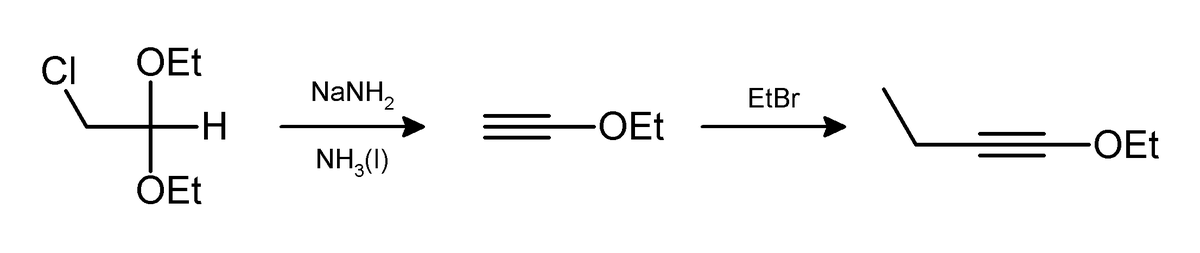Amidure de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Emplois
L'amidure de sodium est utilisé dans les productions industrielles d'indigo, d'hydrazine et de cyanure de sodium. C'est un réactif de choix pour l'assèchement de l'ammoniac (liquide ou gazeux) mais son emploi principal est celui d'une base forte en chimie organique, souvent en solution dans l'ammoniac liquide. L'un des principaux avantages de l'utilisation de l'amidure de sodium est qu'il est une excellente base et un mauvais nucléophile. Cependant, du fait de sa faible solubilité, il est souvent remplacé par des réactifs comme l'hydrure de sodium, le bis(triméthylsilyl)amidure de sodium (NaHMDS) ou le diisopropylamidure de lithium (LDA).
Synthèse des alcynes
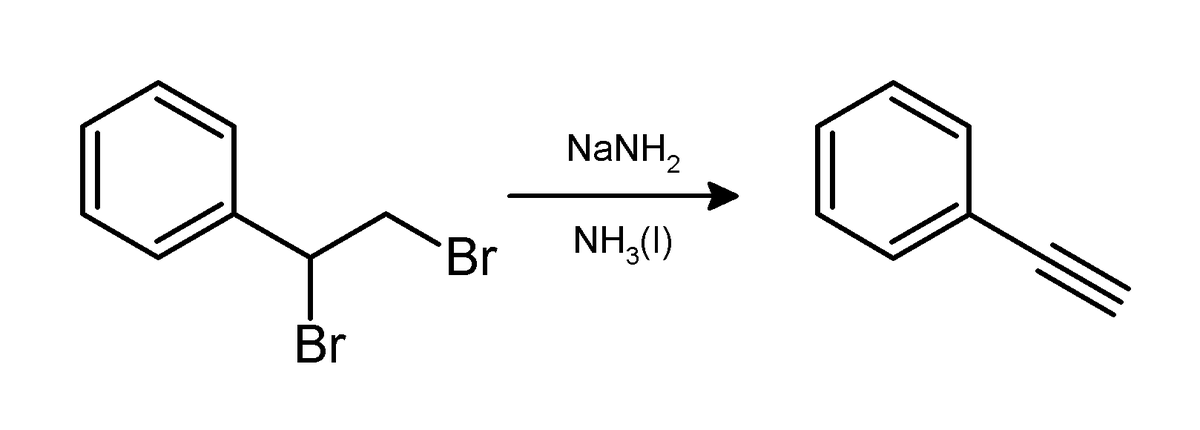
L'amidure de sodium induit la perte de deux molécules de bromure d'hydrogène (HBr) sur les dibromoalcanes vicinaux pour donner une triple liaison carbone-carbone, comme dans la synthèse du phényléthyne:
Normalement deux équivalents d'amidure de sodium produisent l'alcyne désiré. Cependant, trois équivalents sont nécessaires pour la préparation d'un alcyne terminal parce que dans ce type d'alcyne, l'atome d'hydrogène terminal est acide et est immédiatement déprotoné par un équivalent de la base.
Du chlorure d'hydrogène (HCl) et/ou de l'éthanol (C2H5OH) peuvent aussi être éliminés de la même façon comme dans la préparation du 1-éthoxy-but-1-yne:
Réactions de cyclisation
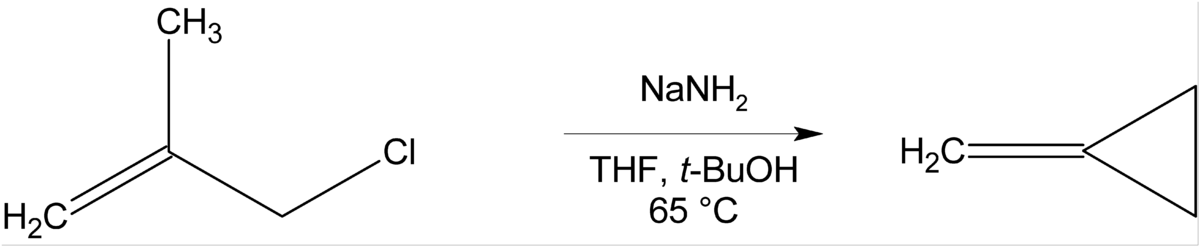
S'il n'y a pas d'atome d'hydrogène en β pouvant être éliminé, des composés cycliques peuvent être formés, comme dans la préparation du méthylènecyclopropane:
Des cyclopropènes, des aziridines et des cyclobutanes peuvent être formés de cette manière.
déprotonation de carbone et d'azote acides
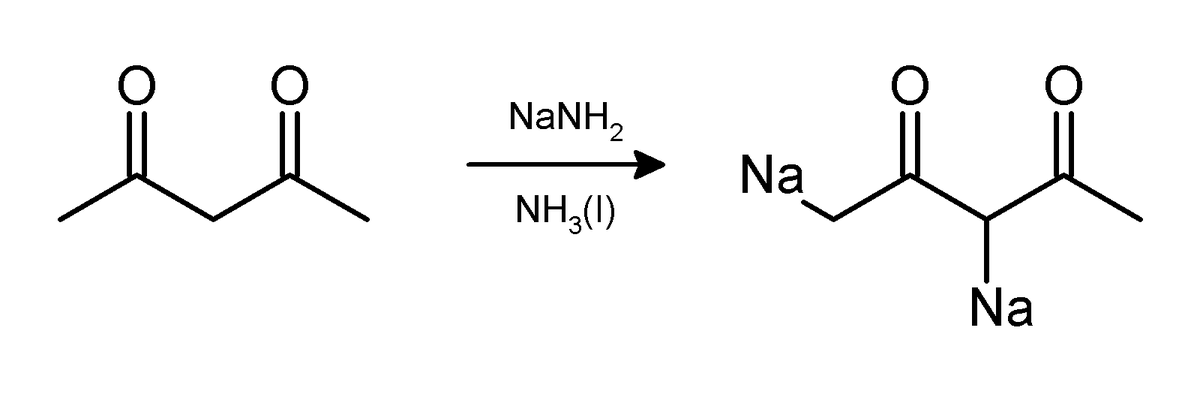
Les atomes de carbone acides qui peuvent être déprotonés par l'amidure de sodium dans l'ammoniac liquide sont, entre autres, les alcynes terminaux, les méthyl cétones, les cyclohexanones, l'acide phénylacétique et ses dérivés et les diphénylméthanes. L'acétylacétone perd deux protons et forme un dianion:
L'amidure de sodium déprotone aussi les indoles et les pipéridines
Autres réactions
- Réarrangement avec ortho-déprotonation.
- Synthèse d'oxiranes (via carbène?)
- synthèse d'indoles
- Réaction de Chichibabin