Allostérie - Définition
La liste des auteurs de cet article est disponible ici.
Exemple de l'hémoglobine
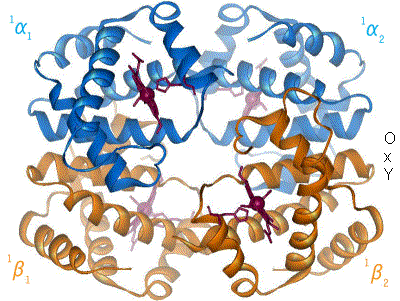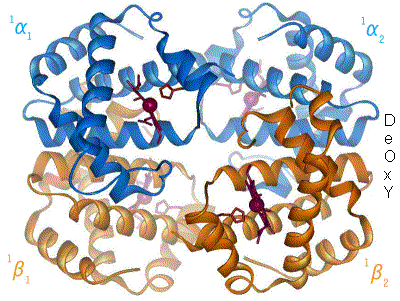
L'hémoglobine constitue un exemple important de protéine allostérique, bien qu'elle ne soit pas une enzyme stricto sensu mais plutôt une molécule de transport. Chaque monomère de l'hémoglobine, qui en comporte quatre, peut fixer une molécule de dioxygène. La fixation de la première molécule de dioxygène augmente l'affinité de liaison de la seconde, la fixation de la seconde augmente l'affinité pour la troisième et ainsi de suite (coopération positive par effet homotrope). Les effecteurs hétérotropes modifiant l'affinité de l'hémoglobine pour le dioxygène sont : le proton H+, le dioxyde de carbone et le 2,3 bisphosphoglycerate (un sous-produit de la glycolyse). Ces régulations ont très souvent un rôle physiologique important et peuvent mener, lors de leur dérèglement, à des troubles physiologiques. Ils agissent comme rapporteurs des conditions extérieures, des senseurs.
Extension de la notion aux canaux ioniques
Par extension, la notion d'allostérie s'applique au cas des canaux ioniques bien qu'il n'y ait pas de réaction chimique catalysée mais plutôt un transfert de matière (ion) à travers une membrane. Dans ce cas, la fixation d'une molécule effectrice positive favorisera l'ouverture du canal, quel que soit le mode d'ouverture du canal et, inversement, pour un effecteur négatif, le processus d'ouverture sera défavorisé. On parle d'agoniste et d'antagoniste des récepteurs allostérique respectivement.

















































