Alcool (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Nomenclature
Lorsque l'alcool est la fonction principale, il suffit de remplacer le suffixe -e de l'alcane correspondant par le suffixe -ol et d'indiquer le numéro de l'atome de carbone où le groupe hydroxyle est fixé, bien que, parfois, lorsqu'elle n'est pas nécessaire à la description, cette dernière information soit omise.
Si elle n'est pas la fonction principale, il faut ajouter le préfixe hydroxy- précédé du numéro de l'atome de carbone où le groupe est fixé.
Pour la base conjuguée de l'alcool, l'ion alcoolate (voir paragraphe acidité), il suffit de remplacer le suffixe -e par le suffixe -olate.(ne pas confondre avec le suffixe "-oate" caractéristique du carboxylate, base conjuguée de l'acide carboxylique.)
Exemples:
- éthan-1-ol:
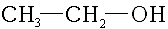
- butan-2-ol:
- acide 3-hydroxy-propanoïque:
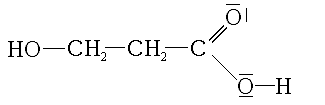
Réactions
Réaction de substitution nucléophile
Les alcools peuvent subir une substitution nucléophile dans laquelle le groupe hydroxyle est remplacé par un autre radical nucléophile.
Transformation en éther-oxyde
Synthèse de Williamson
Passage de l'alcool aux halogénoalcanes
A partir d'un hydracide
- Réaction:
la réaction avec un hydracide, chlorure, bromure ou iodure d'hydrogène pour former un halogénoalcane (halogénure d'alkyle ou encore dérivé halogéné) :
R-OH + HX → R-X + H2O, X représentant l'halogène Cl, Br ou I (F n'est pas utilisé, la réaction est beaucoup trop lente).
Il s'agit de la réaction inverse de la réaction d'hydrolyse des dérivés halogénés.
- Propriétés:
- Réaction lente.
- Réaction réversible
- Elle est favorisée dans le sens direct si l'hydracide est concentré et en excès, dans l'autre sens en cas d'excès d'eau, et en milieu basique.
- stéréochimie : dépend de la classe de l'alcool (voir mécanismes)
- En fonction de la classe de l'alcool, et de la nature de l'hydracide, la réaction est plus ou moins lente et plus ou moins limitée (cela est aussi dû aux mécanismes).
On peut donc effectuer un classement: RIOH < RIIOH < RIIIOH ( "<" = "réagit moins vite et de façon plus limitée que") et HF< Différents composés peuvent être employés pour permettre une halogénation des alcools. Les alcools peuvent subir une réaction d'élimination à haute température en milieu acide et produire des alcènes : Cette réaction peut être inversée pour synthétiser des alcools à partir d'alcènes et d'eau, mais reste peu fiable car elle produit des mélanges d'alcools. En réagissant avec un acide carboxylique, l'alcool forme un ester. Les alcools peuvent être oxydés en aldéhydes, cétones ou acides carboxyliques. Les alcools peuvent être réduits en alcanes à l'aide de tributylétain par une réaction radicalaire appelée réaction de Mac Murry.
A partir de dérivés d'acides inorganiques
Réaction d'élimination (déshydratation)
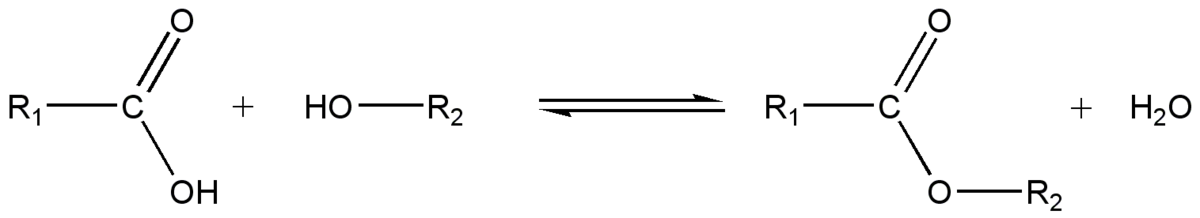
Estérification
Oxydation des alcools
Réduction des alcools