Acier - Définition
La liste des auteurs de cet article est disponible ici.
Aperçu de la composition, des avantages et des inconvénients
La teneur en carbone a une influence considérable (et assez complexe) sur les propriétés de l’acier : en dessous de 0,008 %, l’alliage est plutôt malléable et on parle de « fer » ; au-delà de 2,11 %, les inclusions de carbone sous forme graphite fragilisent la microstructure et on parle de fonte. Entre ces deux valeurs, l’augmentation de la teneur en carbone a tendance à améliorer la résistance mécanique et la dureté de l’alliage ; on parle d’aciers « doux, mi-doux, mi-durs, durs ou extra-durs » (classification traditionnelle).
On modifie également les propriétés des aciers en ajoutant d’autres éléments, principalement métalliques, et on parle d’aciers alliés. De plus, on peut encore améliorer grandement leurs caractéristiques par des traitements thermiques (notamment les trempes) prenant en surface ou à cœur de la matière ; on parle alors d’aciers traités.
Outre ces diverses potentialités, et comparativement aux autres alliages métalliques, l’intérêt majeur des aciers réside d’une part dans le cumul de valeurs élevées dans les propriétés mécaniques fondamentales :
- résistance aux efforts : module d’élasticité, limite élastique, résistance mécanique ;
- dureté ;
- résistance aux chocs (résilience).
D’autre part, leur coût d’élaboration reste relativement modéré, car le minerai de fer est abondant sur terre (environ 5 % de l’écorce) et sa réduction assez simple (par addition de carbone à haute température). Enfin les aciers sont pratiquement entièrement recyclables grâce à la filière ferraille.
On peut néanmoins leur reconnaître quelques inconvénients, notamment leur mauvaise résistance à la corrosion à laquelle on peut toutefois remédier, soit par divers traitements de surface (peinture, brunissage, zingage, galvanisation à chaud, etc.), soit par l’utilisation de nuances d’acier dites « inoxydables ». Par ailleurs, les aciers sont difficilement moulables, donc peu recommandés pour les pièces volumineuses de formes complexes (bâtis de machines, par exemple). On leur préfère alors des fontes. Enfin, lorsque leur grande masse volumique est pénalisante (dans le secteur aéronautique par exemple), on se tourne vers des matériaux plus légers (alliages à base d’aluminium, titane,composites, etc.), qui ont l’inconvénient d’être plus chers.
De ce fait, les aciers restent privilégiés dans presque tous les domaines d’application technique : équipements publics (ponts et chaussées, signalisation), industrie chimique, pharmaceutique et nucléaire (équipements sous pression, équipements soumis l’action de la flamme, récipients divers), agro-alimentaire (conditionnement et stockage), bâtiment (armatures, charpentes, ferronnerie, quincaillerie), industrie mécanique et thermique (moteurs, turbines, compresseurs), automobile (carrosserie, équipements), ferroviaire, aéronautique et aérospatial), médical (instruments, appareils et prothèses), composants mécaniques (visserie, ressorts, câbles, roulements, engrenages), outillage de frappe (marteaux, burins, matrices) et de coupe (fraises, forets, porte-plaquette), mobilier, design et équipements électroménagers, etc.
Composition et structure des aciers
Teneur en carbone
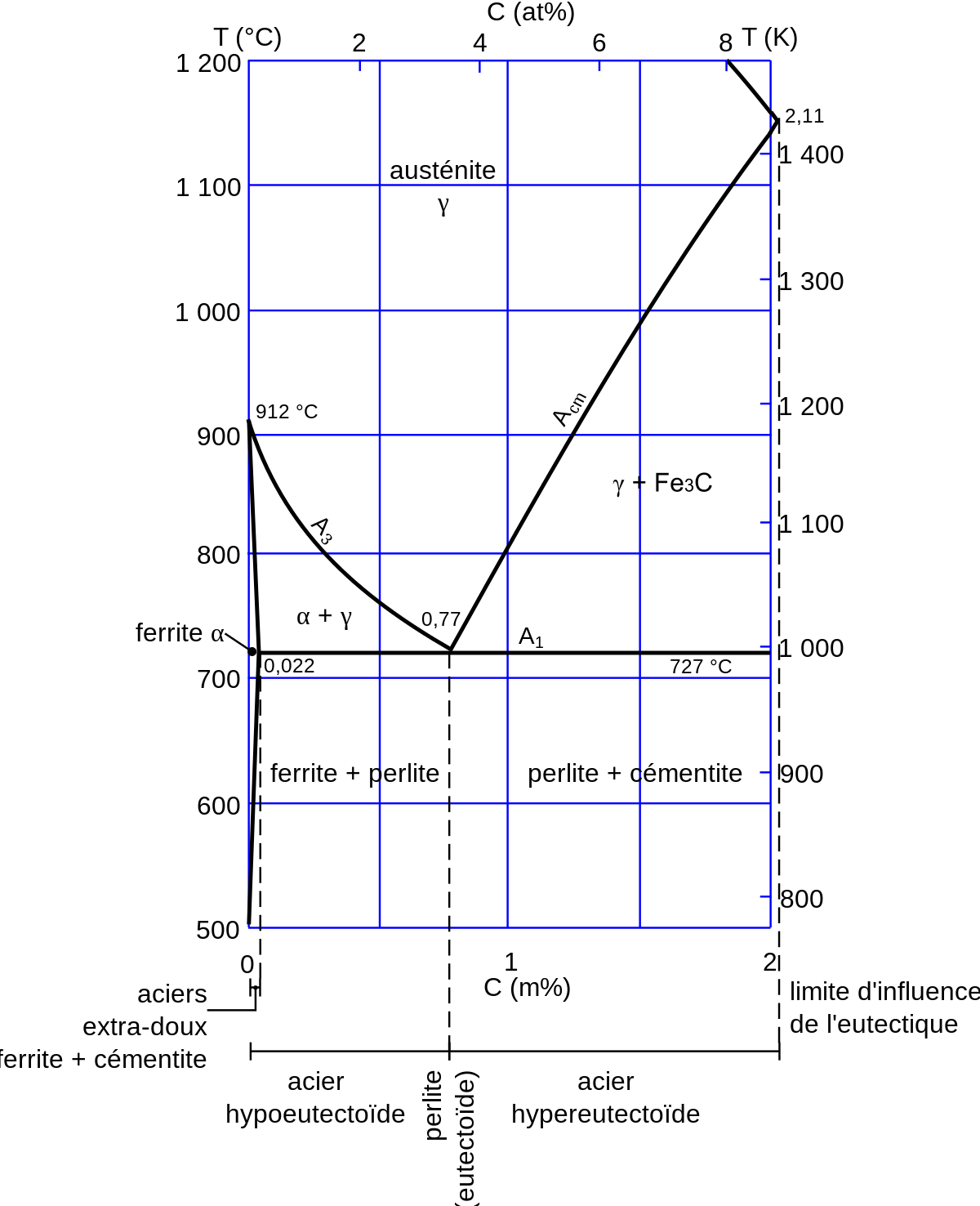
On distingue plusieurs types d’aciers selon le pourcentage massique de carbone qu’ils contiennent :
- les aciers hypoeutectoïdes (de 0,0101 à 0,77 % de carbone) qui sont les plus malléables ;
- les aciers extra-doux ont une teneur inférieure à 0,022 % de carbone ; ils sont hors de la « zone d’influence » de l’eutectoïde (perlite) et n’ont donc pas de perlite ; ils sont durcis par des précipités de cémentite en faible quantité ;
- entre 0,022 et 0,77 % de carbone, la cémentite est présente dans la perlite mais n’existe pas sous forme « seule » ;
- l’acier eutectoïde (0,77 % de carbone) appelé perlite ;
- les aciers hypereutectoïdes (de 0,77 à 2,11 % de carbone) qui sont les plus résistants.
La limite de 2,11 % correspond à la zone d’influence de l’eutectique (lédéburite) ; il existe toutefois des aciers lédéburitiques.
La structure cristalline des aciers à l’équilibre thermodynamique dépend de leur concentration (essentiellement en carbone mais aussi d’autres éléments d’alliage), et de la température. On peut aussi avoir des structures hors équilibre (par exemple dans le cas d’une trempe).
La structure du fer pur dépend de la température :
- jusqu’à 912 °C, le fer (fer α) a une structure cristalline cubique centrée appelée ferrite
- entre 912 °C et 1 394 °C, le fer (fer γ) a une structure cristalline cubique à faces centrées appelée austénite
- entre 1 394 °C et jusqu’à son point de fusion à 1 538 °C, le fer (fer δ) retrouve une structure cristalline cubique centrée appelée ferrite delta (cette ferrite joue un rôle essentiel dans la mise en oeuvre et surtout le soudage des aciers duplex).
La structure du fer + carbone évolue d’une façon plus complexe en fonction de la température et de la teneur en carbone. Les règles diffèrent selon que l’on est hors de la « zone d’influence » de l’eutectoïde (entre 0 % et 0,022 %, entre 0,022 % et 0,77 % (perlite) ou entre 0,77 % et 2,11 % (au-delà, il s’agit de fonte). Voir l’étude du diagramme fer-carbone.
D’une manière simplifiée, pour un carbone compris entre 0,022 % et 2,11 % :
- jusqu’à 727 °C on trouve un mélange de ferrite et de cémentite ;
- à partir de 727 °C le fer α se transforme en fer γ (changement de phase appelé austénitisation). La température de fin de transformation dépend de la teneur en carbone.
Les aciers non alliés (au carbone) peuvent contenir jusqu’à 2,11 % en masse de carbone. Certains aciers alliés peuvent contenir plus de carbone par l’ajout d’éléments dits « gammagènes ».
| Les différentes phases de l’acier | |
|---|---|
| Austénite • Bainite • Cémentite • Ferrite • Martensite • Perlite | |
Éléments d'alliage
Le carbone a une importance primordiale car c'est lui qui, associé au fer, confère à l'alliage le nom d'acier. Son influence sur les propriétés mécaniques de l'acier est prépondérante. Par exemple, en ce qui concerne l'amélioration de la propriété de dureté, l'addition de carbone est trente fois plus efficace que l'addition de manganèse.
L’aluminium : excellent désoxydant. Associé à l’oxygène, réduit la croissance du grain en phase austénitique. Peut rendre l’acier inapte à la galvanisation à chaud.
Le chrome : c’est l’élément d’addition qui confère à l’acier la propriété de résistance mécanique à chaud et à l’oxydation (aciers réfractaires). Il joue aussi un rôle déterminant dans la résistance à la corrosion lorsqu’il est présent à une teneur de plus de 12 à 13 % (selon la teneur en carbone). Additionné de 0,5% à 9% il augmente la trempabilité (famille des aciers au chrome). Il a un rôle alphagène.
Le cobalt : utilisé dans de nombreux alliages magnétiques. Provoque une résistance à l’adoucissement lors du revenu.
Le manganèse : forme des sulfures qui améliorent l’usinabilité. Augmente modérément la trempabilité.
Le molybdène : augmente la température de surchauffe, la résistance à haute température et la résistance au fluage. Augmente la trempabilité.
Le nickel : rend austénitiques (role gammagène) les aciers à forte teneur en chrome. Sert à produire des aciers de trempabilité modérée ou élevée (selon les autres éléments présents), à basse température d’austénitisation et à ténacité élevée après traitement de revenu. C’est l’élément d’alliage par excellence (jusqu’à une teneur de 9 %) des aciers pour application cryogéniques.
Le niobium : même avantage que le titane mais beaucoup moins volatile. Dans le domaine du soudage il le remplace donc dans les métaux d’apport.
Le phosphore : augmente fortement la trempabilité. Augmente la résistance à la corrosion. Peut contribuer à la fragilité de revenu.
Le silicium : favorise l’orientation cristalline requise pour la fabrication d’un acier magnétique, augmente la résistivité électrique. Améliore la résistance à l’oxydation de certains aciers réfractaires. Utilisé comme élément désoxydant.
Le titane : pouvoir carburigène élevé (comme le niobium) et réduit donc la dureté de la martensite. Élimine le carbone en solution à haute température et réduit le risque de corrosion intergranulaire (TiC se forme avant Cr23C6 évite donc l’appauvrissement en chrome au joint de grain).
Le tungstène : améliore la dureté à haute température des aciers trempés revenus. Fonctions sensiblement identiques à celles du molybdène.
Le vanadium : augmente la trempabilité. Élève la température de surchauffe. Provoque une résistance à l’adoucissement par revenu (effet de durcissement secondaire marqué).
Structure des aciers
Lors du refroidissement d’un lingot, l’acier se solidifie à l’état d’austénitique. Au cours du refroidissement, à 727 °C, l’austénite se décompose, soit en ferrite + perlite, soit en perlite + cémentite. La vitesse de refroidissement ainsi que les éléments d’alliage ont une importance capitale sur la structure obtenue, et donc sur les propriétés de l’acier. En effet :
- les joints de grain bloquent les dislocations, donc augmentent la dureté et la limite élastique ; or, plus les grains sont petits, plus il y a de joints de grain…
- la cémentite est un carbure, une céramique très dure ; sa présence augmente la dureté et la limite élastique, mais diminue la ductilité.
De manière générale :
- un refroidissement rapide donne de petits grains, alors qu’un refroidissement lent donne de gros grains ;
- la réorganisation des atomes pour passer de la structure austénitique (cubique à faces centrées) à la structure ferritique (cubique centrée) se fait par des mouvements d’atomes de faible ampleur (quelques distances interatomiques) ;
- la ferrite pouvant contenir moins de carbone dissout (voir Solution solide et Site interstitiel), le carbone doit migrer sur de plus grandes distances pour former de la cémentite ; la distance à parcourir est moins grande dans le cas de la perlite (eutectoïde), puisque la cémentite s’intercale entre des « tranches » de ferrite ;
- la germination des nouveaux cristaux se fait de manière préférentielle aux défauts, et notamment aux joints de grain de l’austénite ; ainsi, la structure de solidification de l’austénite joue un rôle important (voir Solidification).
Certains éléments chimiques peuvent « piéger » le carbone pour former des carbures (par exemple le titane ou l’aluminium). Ils empêchent ainsi la formation de cémentite.
On peut modifier la structure de l’acier par des traitements thermomécaniques :
- déformations : écrasement du lingot, laminage à froid ou à chaud, forgeage…
- traitements thermiques, qui permettent de « rejouer » le refroidissement :
- trempe, éventuellement suivie d’un revenu : la rapidité de la transformation ne permet pas au carbone de diffuser et le « piège » dans la maille cubique centrée, qui se déforme pour donner de la martensite ; les cristaux forment de petites aiguilles ;
- une trempe plus lente, ou bien une trempe étagée, permet la formation de bainite ;
- recuit, permettant la diffusion des éléments, la réorganisation des atomes et l’élimination des dislocations.
La métallurgie des poudres consiste à compacter de la poudre d’acier et de la chauffer en dessous de la température de fusion, mais suffisamment pour que les grains se « soudent » (frittage). Cela permet de maîtriser la structure de l’acier et son état de surface (en particulier pas de retrait ni de retassure), mais introduit de la porosité.