Acide ribonucléique de transfert - Définition
La liste des auteurs de cet article est disponible ici.
Structure des ARNt
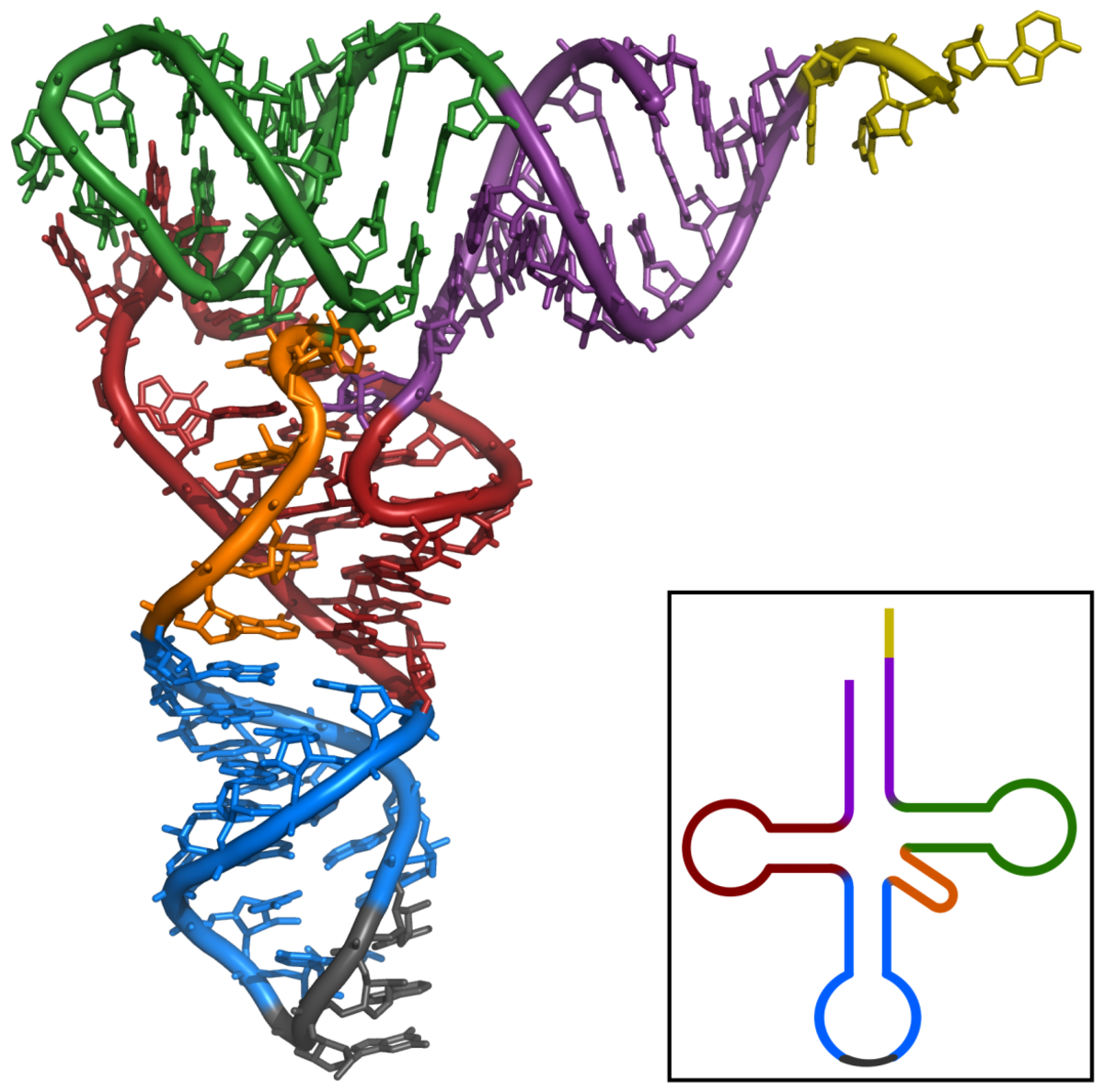
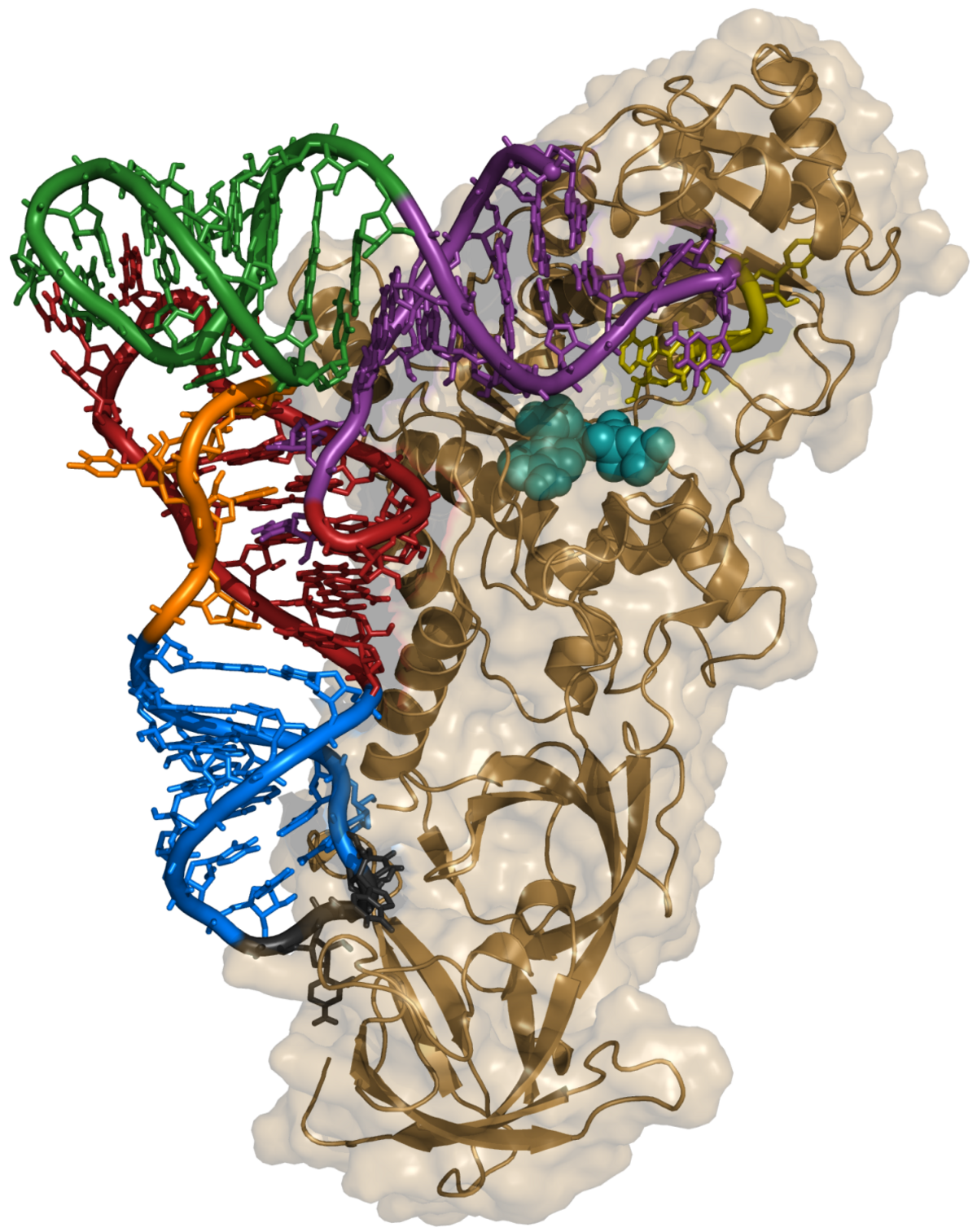
La plupart des ARNt ont une structure canonique, conservée chez toutes les espèces. Ils se replient sur eux mêmes, formant des appariements intramoléculaires de nucléotides pour donner une structure à quatre tiges ou bras, appelée "feuille de trèfle" (figure 1). La tige supérieure, qui porte les extrémités 5' et 3' s'appelle le bras accepteur, car c'est lui qui porte (accepte) l'acide aminé. La tige inférieure, terminée par la boucle de l'anticodon s'appelle bras anticodon, les deux autres tiges s'appellent bras T et bras D (figure 1), car ils portent des ribonucléotides modifiés, autres que A, G, C et U : la ribothymidine (T), pour le bras T et la dihydrouridine (D) pour le bras D.
Ces quatre tiges se replient en trois dimensions pour former une structure en forme de "L" (figure 2). Celle-ci résulte de l'empilement coaxial deux à deux des tiges : le bras T sur bras accepteur et le bras anticodon sur le bras D. Cette structure en forme de "L" est stabilisée par des interactions entre la boucle T et la boucle D, qui fait intervenir des nucléotides modifiés, que l'on retrouve conservés dans la plupart des ARNt. L'extrémité 5' ne présente qu'un seul phosphate. L'extrémité 3' comporte quatre nucléotides non appariés et se termine toujours par le trinucléotide CCA , dont l'adénosine terminale porte la fonction OH où est estérifié l'acide aminé,
Nucléotides modifiés
Les ARNt se caractérisent par la présence d'un grand nombre de nucléotides non-canoniques, ou nucléotides modifiés, dans leur structure. Ces modifications de nucléotides : méthylation, isomérisation, thiolation, réduction... sont incorporées post-transcriptionnellement par des enzymes spécialisées.
On trouve deux grandes classes de nucléotides modifiés dans l'ARNt : ceux qui participent à l'établissement de la stabilisation de la structure tridimensionnelle, par exemple la ribothymidine et la pseudouridine dans la boucle T, et ceux qui sont localisés dans la boucle de l'anticodon et qui interviennent directement dans l'interaction avec l'ARNm et dans la lecture des codons, comme par exemple l'inosine ou ses dérivés.
Certaines modifications de nucléotides sont très simples : ajout d'un groupement méthyle (CH3) et d'autres sont très complexes et nécessitent l'intervention de plusieurs enzymes.
ARNt et aminoacyl-ARNt synthétase
L'estérification de l'acide aminé spécifique à l'extrémité 3'-OH de l'ARNt est une étape clef du décodage du code génétique. On appelle cette étape l'aminoacylation et, dans toutes les cellules vivantes, il existe une vingtaine d'enzymes, les aminoacyl-ARNt synthétases, dont la fonction est de catalyser cette étape.
Chacune de ces enzymes est spécifique d'un acide aminé donné et reconnait le ou les ARNt correspondant. Ces enzymes sont capables de discriminer les ARNt spécifiques de son acide aminé, en reconnaissant des motifs de nucléotides particuliers, souvent dans l'anticodon lui-même, mais parfois dans d'autres régions de l'ARNt. Cette reconnaissance est cruciale, car il n'y a plus de contrôle qualité ultérieur au niveau du ribosome : toute erreur dans l'aminoacylation se traduira donc ensuite par une erreur dans le décodage du message génétique.
L'aminoacylation comprend deux étapes: l'activation de l'acide aminé par adénynylation et la formation du lien ester entre l'acide aminé et l'hydroxyle 2' ou 3' du ribose du nucléotide 3' de l'ARN de transfert.
La première étape consiste en l'attaque nucléophile de l'acide aminé sur une molécule d'ATP reconnue par l'aminoacyl-ARNt synthétase. L'oxygène de cet acide aminé brisera le lien entre le premier et le second des trois phosphates de l'ATP. Ainsi, il se formera un nouveau lien, un lien anhydride, entre l'acide aminé et l'AMP (adénosine monophosphate) ainsi généré. L'acide aminé est ainsi activé sous forme d'aminoacyl-adénylate, qui reste lié à l'enzyme.
Deuxième étape: catalyse d'un lien ester par l'ARNt. En utilisant l'énergie contenue dans l'aminoacyl-adénylate, l'ARN de transfert fera une attaque nucléophile sur l'acide aminé. Cela créera un lien ester, qui sera encore riche en énergie.
Après ces deux étapes, l'ARN de transfert est prêt à amener son acide aminé spécifique vers le ribosome et l'ARN messager.