Acide phosphorique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide phosphorique | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | Acide orthophosphorique | |
| No CAS | ||
| No EINECS | ||
| No E | E338 | |
| FEMA | ||
| Apparence | Solide blanc ou liquide visqueux incolore (T>42 °C) | |
| Propriétés chimiques | ||
| Formule brute | H3PO4 | |
| Masse molaire | 97,9952 ± 0,0014 g·mol-1 | |
| pKa | 2,12, 7,21, 12,67 | |
| Propriétés physiques | ||
| T° fusion | 42,35 °C | |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 213 °C | |
| Solubilité | Sol dans l'alcool; sol dans 8 vol d'un mélange d'éther:alcool à 3:1; | |
| Masse volumique | 1,834 g·cm-3 à 18 °C | |
| Pression de vapeur saturante | à 20 °C : 4 Pa | |
| Viscosité dynamique | 3,86 mPa·s (solution à 40%, 20 °C) | |
| Précautions | ||
| | ||
| ||
| Phrases R : 34, | ||
| Phrases S : (1/2), 26, 45, | ||
| | ||
|
0 3 0 | ||
| | ||

| ||
| | ||

Danger | ||
| Inhalation | Sensation de brûlure. Toux. Essoufflement. Mal de gorge. | |
| Peau | Rougeur. Douleur. Brûlures cutanées. Ampoules. | |
| Yeux | Douleur. Rougeur. Brûlures profondes graves. | |
| Ingestion | Douleurs abdominales. Sensation de brûlure. Choc ou collapsus. | |
| Composés apparentés | ||
| Autres composés | Acide hypophosphoreux, Acide phosphoreux, Acide pyrophosphorique | |
| | ||
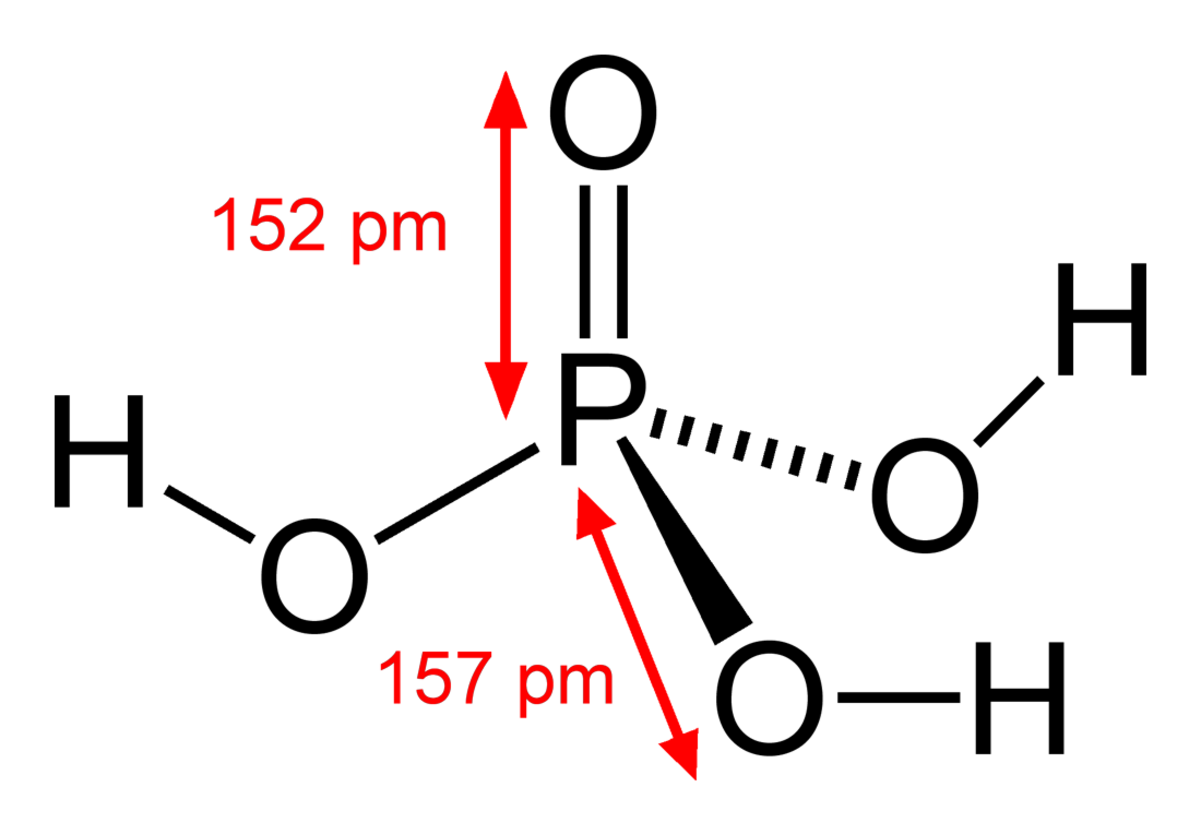
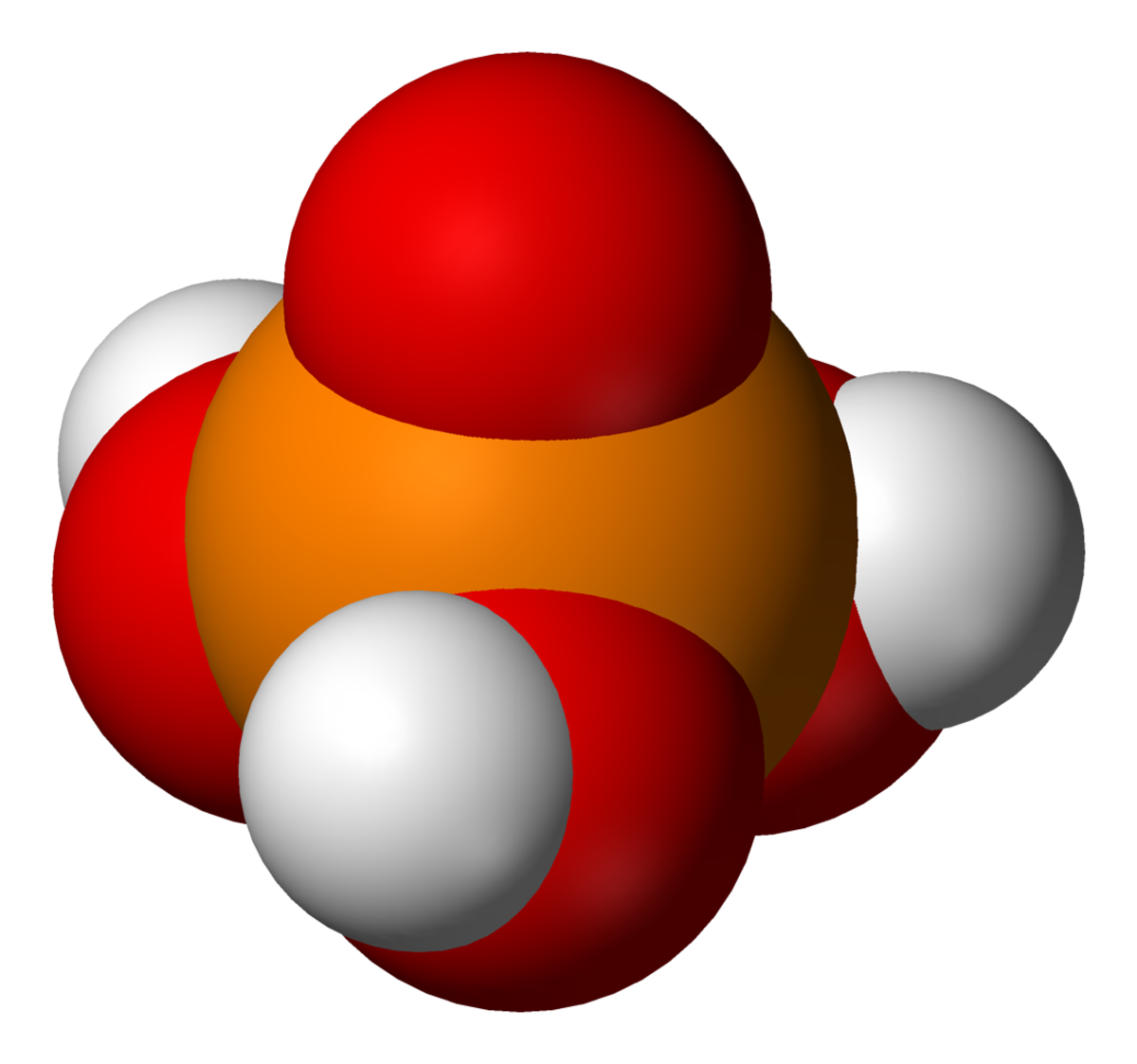
L'acide phosphorique est un oxacide à base de phosphore de formule H3PO4. C'est un triacide. Il intervient souvent en minéralogie et a une importance capitale en biochimie.
Description
L'acide orthophosphorique ( o-phosphorique ) ou simplement acide phosphorique est un acide minéral obtenu par traitement du minerai de phosphate ou par combustion du phosphore.
À température ambiante, l'acide phosphorique est un solide cristallin de densité 1,83, qui fond à 42,35 °C. L'acide phosphorique est ordinairement stocké et vendu sous forme de solution finale.
Il constitue la matière première de base pour la production de phosphates (ou sels phosphatés). Sa formule chimique est H3PO4.
Biologie
Les dimères et trimères de l'acide phosphorique interviennent dans de nombreux domaines en biologie comme les transporteurs d'énergie ADP/ATP, l'ADN et dans les os.
Chimie
Il s'agit d'un polyacide capable de céder trois protons, on l'appelle donc triacide. Il cède trois protons H + pour former les Bases : dihydrogénophosphate, hydrogénophosphate, et orthophosphate :
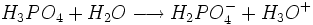
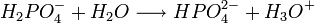
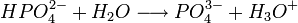
Utilisations
L'acide phosphorique est très utilisé en laboratoire, car il résiste à l'oxydation, à la réduction et à l'évaporation.
L'acide phosphorique est employé dans les boissons non alcoolisées comme régulateur de pH ( E338) : principalement dans les sodas au cola (Coca-Cola, Pepsi Cola).
L'acide phosphorique est employé comme composant des ciments dentaires, comme catalyseur ou dans les métaux inoxydables, et dans la production des phosphates — utilisés dans les adoucisseurs d'eau, les engrais et les détergents.
L'acide phosphorique est souvent utilisé en solution dans des produits utilisés en mécanique pour dérouiller les pièces métalliques. Il sert aussi à "phosphater" les pièces pour les protéger de l'oxydation à l'air libre.



















































