Acide nitrique - Définition
La liste des auteurs de cet article est disponible ici.
Réactions chimiques comportant l’acide nitrique
Action sur les métaux
L’acide nitrique réagit différemment des autres acides forts (HCl, H2SO4) sur les métaux à cause des propriétés oxydantes du radical NO3. Ainsi, HNO3 réagissant sur un métal ne donne jamais de dégagement de dihydrogène, ce qui est le cas pour la plupart des autres acides réagissant sur un métal. La formule suivante donne l’équation de la réaction globale pour toute réaction chimique entre l’acide nitrique (HNO3) et un métal
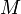
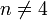
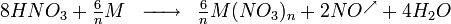
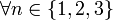
Les métaux tels que le nickel, le cobalt, le cuivre, le mercure, l'argent, le plomb, le sélénium, le bismuth, le zinc et le cadmium se dissolvent dans l'acide nitrique. D'autres métaux forment un film de passivation, parmi lesquels figurent l'aluminium, le chrome, le titane, le zirconium, le hafnium, le gallium, l'induim, le niobium, le tantale, le thorium et le bore. Les alcalino-terreux se dissolvent dans l'acide dilué, mais passivent dans l'acide concentré. Les alliages à base de fer se dissolvent mieux dans l'acide dilué.
Propriétés physico-chimiques
L’acide nitrique pur est un liquide incolore et inodore ; diverses impuretés le colorent souvent en jaune brun. À température ambiante, il libère des fumées rouges ou jaunes, du fait de sa décomposition partielle en dioxyde d’azote sous l’effet de la lumière.
L’acide nitrique est un agent oxydant puissant; ses réactions avec des composés comme les cyanures, carbures, et poudres métalliques peuvent être explosives.
Les réactions de l’acide nitrique avec beaucoup de composés organiques, comme la térébenthine, sont violentes, le mélange étant hypergolique (c’est-à-dire auto-inflammable).
C’est un acide fort de pKa = -2 : en solution aqueuse, il se dissocie complètement en un ion nitrate NO- et un proton hydraté. Les sels de l’acide nitrique (qui contiennent l’ion nitrate) sont appelés des nitrates. La quasi totalité d’entre eux sont très solubles dans l’eau.
L’acide nitrique et ses sels, les nitrates, ne doivent pas être confondus avec l’acide nitreux et ses sels, les nitrites.
| Gew % HNO3 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Masse volumique (g/cm³) | 1,00 | 1,05 | 1,12 | 1,18 | 1,25 | 1,31 | 1,37 | 1,42 | 1,46 | 1,48 | 1,513 |
| Viscosité (mPa·s) | 1,00 | 1,04 | 1,14 | 1,32 | 1,55 | 1,82 | 2,02 | 2,02 | 1,84 | 1,47 | 0,88 |
| Tfus (°C) | 0 | -7 | -17 | -36 | -30 | -20 | -22 | -41 | -39 | -60 | -42 |
| Teb (°C) | 100,0 | 101,2 | 103,4 | 107,0 | 112,0 | 116,4 | 120,4 | 121,6 | 116,6 | 102,0 | 86,0 |
| p(HNO3) (mbar) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,3 | 1,2 | 3,9 | 14,0 | 36,0 | 60,0 |
| p(H2O) (mbar) | 23,3 | 22,6 | 20,2 | 17,6 | 14,4 | 10,5 | 6,5 | 3,5 | 1,2 | 0,3 | 0,0 |
Utilisations
Utilisé communément comme un réactif de laboratoire, notamment pour des réactions de nitration de composés organiques, il est utilisé pour fabriquer par synthèse chimique des engrais comme le nitrate d’ammonium.75% de la production d’acide nitrique est utilisée dans la fabrication d’engrais azotés.
Comme il réagit avec la plupart des métaux (sauf l’or, l’iridium et le platine), il est très utilisé en métallurgie et en microélectronique. Mélangé avec l’acide chlorhydrique, il forme l’eau régale, l’un des rares réactifs capable de dissoudre l’or et le platine.
Il a été l’un des premiers comburants des mélanges de propergols pour les moteurs-fusée, associé au kérosène, à l’1,1-diméthylhydrazine-UDMH -Diméthylhydrazine asymétrique ((CH3)2N-NH2)- et au MMH -monométhylhydrazine (CH3-NH-NH2)- comme carburant. Dans cette utilisation, le caractère très corrosif de l’acide nitrique a été longtemps un problème, résolu par l’addition de 0,6% d’acide fluorhydrique qui assure une passivation du métal. Il est remplacé depuis le début des années 1990 par le tétraoxyde d’azote(N2O4). Il est aussi utilisé pour des décapants industriels, à petite dose. On obtient de la nitroglycérine en le mélangeant avec de la glycérine.
Il a été utilisé au XIXe siècle pour la conservation de la viande.

















































