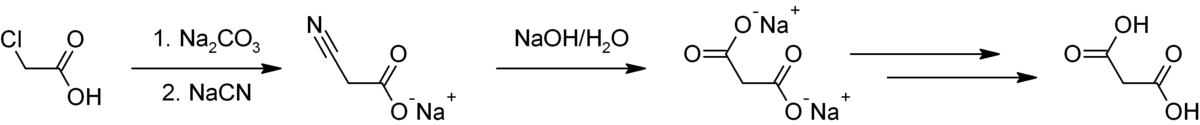Acide malonique - Définition
La liste des auteurs de cet article est disponible ici.
Toxicité et règles de sécurité
Composé inflammable, aux vapeurs irritantes et nocives
L'acide malonique est un produit instable. Chauffé vers 140 °C, il se décompose en fumées toxiques ou en vapeurs potentiellement inflammables. Un début d'incendie peut être arrêté à l'aide de poudre CO2, d'agents chimiques secs, de mousses ou d'eau pulvérisée.
Les vapeurs sont irritantes pour les muqueuses, la peau et les yeux. L'acide malonique peut être absorbé par les voies respiratoires et digestives. Il est nocif en cas d'ingestion et fortement irritant pour les conduits pulmonaires.
Il faut éviter un stockage fourre-tout, en présence de bases, d'agents oxydants ou réducteurs.
Inhibiteur biochimique et poison cellulaire
L'acide malonique est un inhibiteur enzymatique, analogue de structure. Il entre en compétition avec l'acide succinique lors de la deshydrogénase succinique, étape du cycle des acides tricarboxyliques. Le métabolisme cellulaire est retenu et peut être entravé, ce qui implique des conséquences perturbatrices du cycle de Krebs.
L'acide malonique est un poison cellulaire, fort dangereux du fait de sa solubilité dans l'eau et les liquides physiologiques, ainsi que sa tension de vapeur relativement élevée qui accroît les risques accidentels d'inhalation.
Préparation, fabrications industrielles et usages
Produit d'oxydation du jus de pomme, mais aussi isolé dans le suc de betterave à sucre, l'acide malonique est un exemple caricatural de produit chimique naturel et toxique.
il est fabriqué industriellement en partant de l'acide chloroacétique.
le carbonate de sodium génère le sel de sodium de l'acide qui alors réagit avec le cyanure de sodium pour former l'acide cyanoacétique via une substitution nucléophile. Le groupe nitrile est hydrolysé avec de l'hydroxyde de sodium en malonate de sodium dont l'acidification fournit l'acide malonique.
Ce composé est commun dans les fabriques de produits pharmaceutiques.
Les dérivés d'acide malonique, en particulier les esters maloniques qui protègent la fonction acide carboxylique d'une éventuelle dégradation ou favorisent une réactivité dirigée, interviennent dans des importantes synthèses :
- Le malonate de diéthyle s'additionne à l'urée par une liaison amide pour former un hétérocycle l'acide barbiturique et de l'éthanol. Si le carbone central de l'acide malonique est diversement substitué, on obtient d'autres composés barbituriques.
- La synthèse malonique permet de fixer sur le carbone central de l'acide malonique une ou deux chaînes carbonées choisies, la suppression d'une des deux fonctions acides carboxyliques est acquise par chauffage avec une facile réaction finale de décarboxylation après une préalable desestérification.
Danger de confusion des appellations triviales
Il ne faut pas confondre l'acide malonique et les sels d'anion ou encore les esters couramment nommés malonates, avec l'acide malique et les malates, ou l'acide maléique et les maléates.
L'appellation attribuée par les chimistes provient toutefois d'une même racine, malum en latin, signifiant la pomme en latin, mais les molécules ou les anions diffèrent par leurs structures et leurs propriétés.