Acide aminé - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un acide aminé est une molécule organique possédant un squelette carboné et deux fonctions : une amine (-NH2) et un acide carboxylique (-COOH). Les acides aminés sont les unités structurales de base des protéines.
Le premier de tous les acides aminés, l'asparagine, a été identifié en 1805 par deux chimistes français, Pierre Jean Robiquet et Louis Nicolas Vauquelin.
Les atomes de carbone de la chaîne carbonée sont ordonnés par rapport au groupe carboxyle et nommés par une lettre grecque : l'atome de carbone directement lié au groupe carboxyle est le carbone α, et si le groupe amino est aussi sur ce carbone, il s'agit d'un acide carboxylique aminé en position α, autrement dit un acide α-aminé. Par exemple, la lysine est un acide α-aminé portant un deuxième groupe aminé en position ε.
Il existe plus de 100 acides α-aminés présents dans la nature, certains ont été découverts sur des météorites, notamment les chondrites carbonées. 22 acides aminés sont représentés dans le code génétique animal.
Dans la cellule, les acides aminés peuvent exister à l'état libre ou de biopolymères (peptides ou protéines). On peut ainsi distinguer différentes catégories d’acides aminés :
- Certains acides aminés sont retrouvés dans les protéines, et sont capables de participer in vivo à la synthèse de ces protéines. Ce sont donc à la fois des constituants et des précurseurs des protéines.
- Certains acides aminés sont retrouvés dans les protéines uniquement après leur biosynthèse (car ils ne se forment qu'après incorporation d’un autre acide aminé dans la molécule protéique).
- Certains acides aminés n'existent qu'à l'état libre. Bien qu'il existe de nombreux acides aminés dans la nature, l'hydrolyse des protéines ou peptides naturels conduit à 20 acides aminés.
Ces acides aminés sont les « maillons » qui constituent les protéines. Celles-ci sont comparables à des « colliers » constitués de cent à plusieurs milliers de ces « perles », reliées de manière covalente au moyen de fonctions amine et carboxylique (liaison peptidique). L'enchaînement des acides aminés constitue la structure primaire des protéines. Toutefois, ces dernières tirent leur propriétés de leur structure tertiaire, ou repliement spatial. Si le nombre d'acides aminés est inférieur à 20, on parle de peptide, et de 20 à 100 de polypeptide.
Structure générale
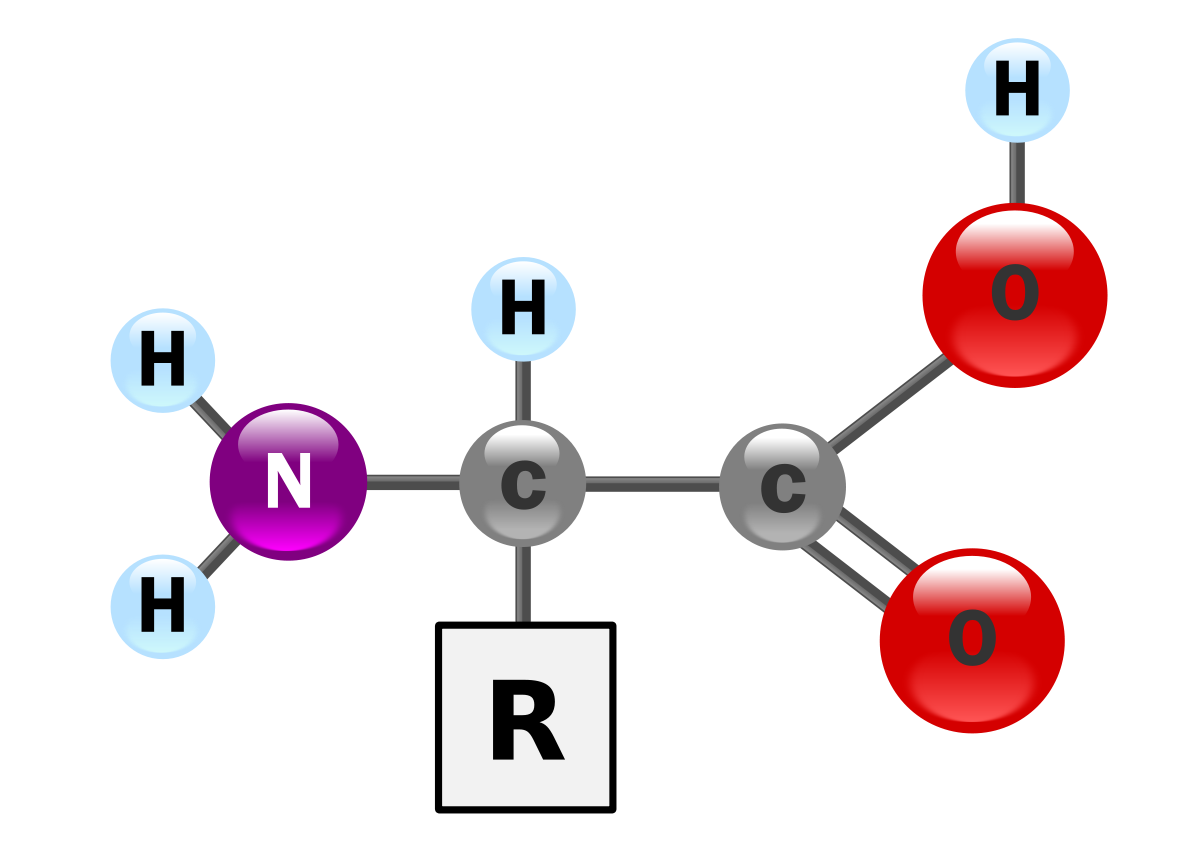
Les acides aminés naturels sont essentiellement des acides α-aminés répondant à la structure générale :
Le complexe ci-contre sans R est appelé radical ou chaîne principale, il est commun à tous les acides aminés. R représente une chaîne latérale spécifique à chaque acide aminé. Les acides aminés sont en général classés d'après les propriétés de la chaîne latérale en cinq groupes : acide, basique, neutre, hydrophile (polaire) ou hydrophobe (apolaire).
Isomérie
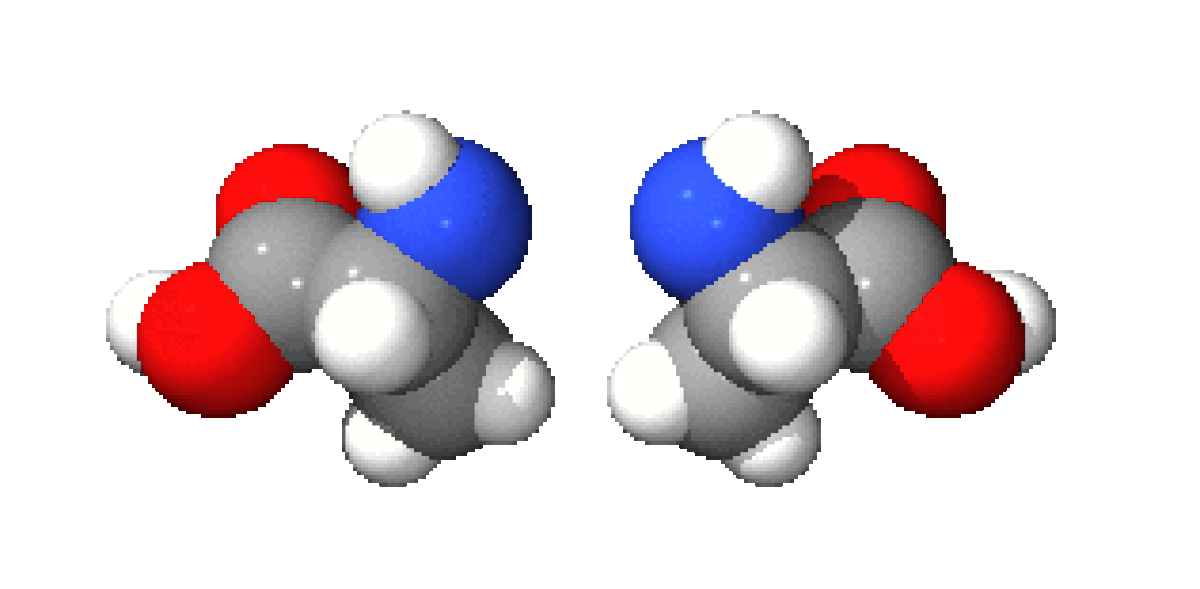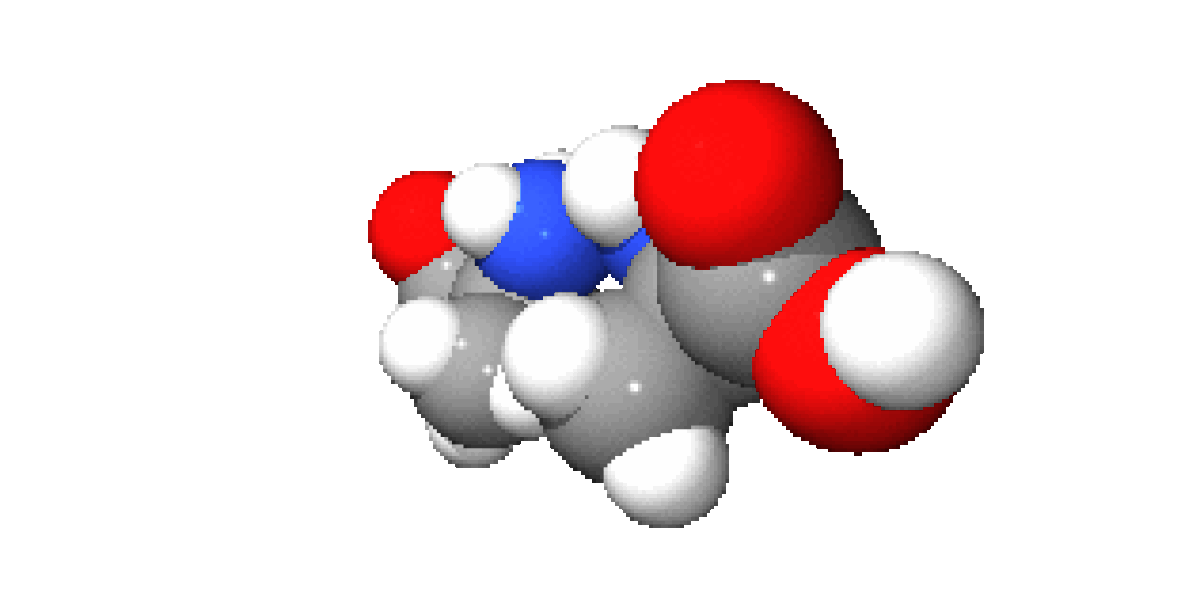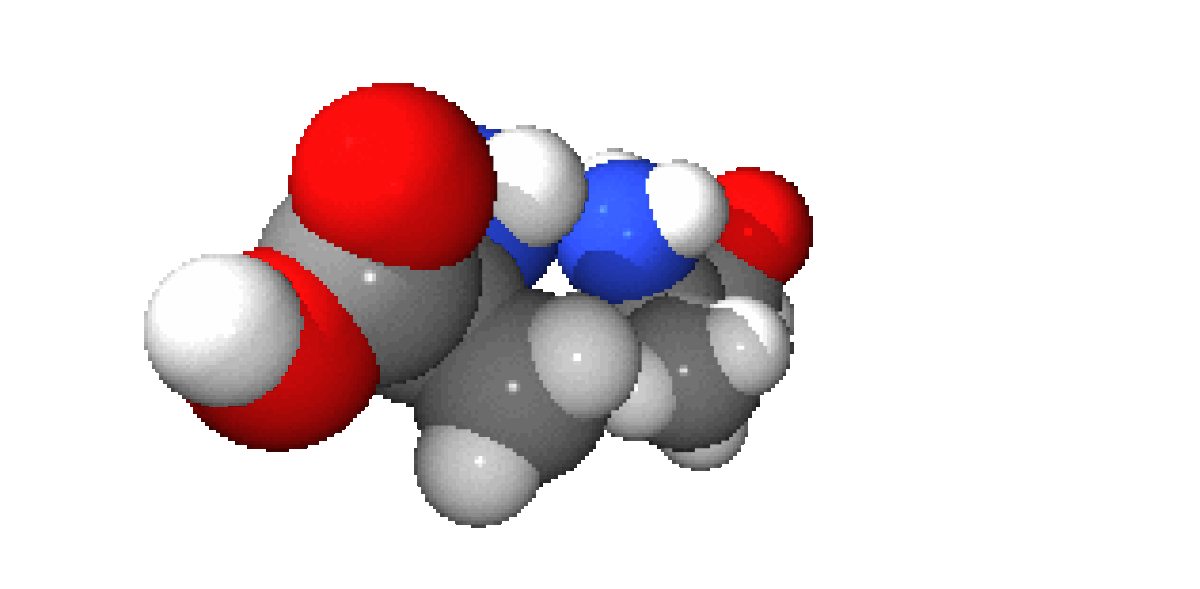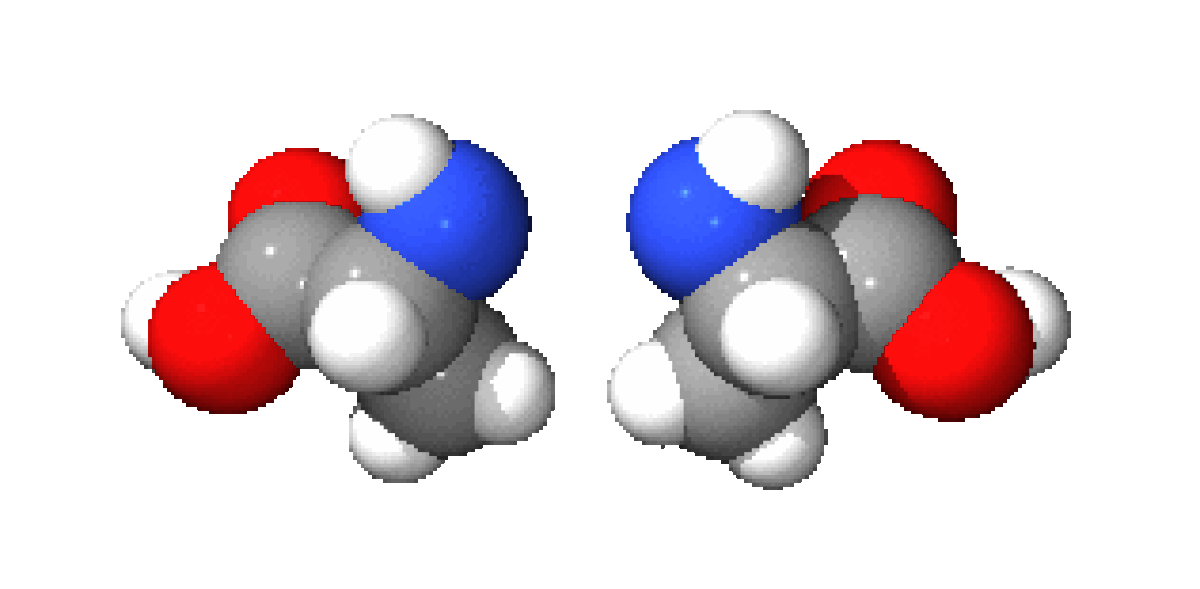
A part la glycine, où R = H, les acides aminés existent sous la forme de deux énantiomères, traditionnellement appelés D et L, selon que le groupe (-NH2) se trouve respectivement à droite ou à gauche dans la projection de Fischer. En l'occurrence, comme le groupement acide est le plus souvent prioritaire selon les règles de Cahn, Ingold et Prelog par rapport au substituant R, les acides aminés L naturels ont le plus souvent une configuration absolue S tandis que les D sont R. La cystéine ou R=CH2SH est une exception à ce schéma car, dans ce cas, R est prioritaire par rapport à COOH.
Ces énantiomères sont optiquement actifs : chaque isomère dévie la lumière plane polarisée et est dextrogyre (+) ou lévogyre (-) suivant que la rotation du plan de polarisation de la lumière suit un sens horaire ou antihoraire. Il n'y a pas de corrélation entre le sens de rotation du plan de polarisation (ou pouvoir rotatoire) et la configuration de l'acide aminé : ainsi la L-alanine est lévogyre et se note L(-)-alanine. Par convention, il y a correspondance entre la représentation des oses et celle des acides aminés.
Les acides aminés L représentent la quasi totalité des acides aminés qui se trouvent dans les protéines. En effet, des enzymes dégradent les acides aminés dextrogyres qui pourraient être fatals, sauf dans certaines régions bien spécifiques (Ex: MP). Certains de ces acides aminés, comme la thréonine, possèdent un 2e carbone asymétrique. Dans ce cas, le composé naturel est appelé L, les 2 autres stéréoisomères dont les positions relatives des substituants sont différentes sont appelés "allo". Ceux-ci ne sont pas présents dans les protéines. Les acides aminés D se rencontrent dans certaines protéines produites par des organismes exotiques au fond des océans, comme certains mollusques. Ce sont également des composants abondants des parois cellulaires des bactéries.