Acétylène - Définition
La liste des auteurs de cet article est disponible ici.
Utilisation
Des applications de l’acétylène :
- la forte teneur en carbone donne une flamme très éclairante utilisée par exemple dans les lampes à acétylène (calebombe) des spéléologues ;
- la haute chaleur de combustion de l’acétylène permet d'atteindre de haute température (3 200 °C dans l'oxygène pur), ce qui en fait un candidat idéal comme combustible pour la soudure. Une des particularités de la combustion de l'acétylène est sa combustion en 2 temps : l'acétylène réagit en premier avec l'oxygène pour donner du monoxyde de carbone et de l'hydrogène, puis ces produits réagissent dans un second temps pour former du dioxyde de carbone et de l'eau. Le monoxyde de carbone et l'hydrogène sont des gaz réducteurs, ce qui en fait des réactifs appréciés en soudure de l'acier pour réduire les oxydes de fer issus de la réaction entre le fer et l'oxygène à haute température, permettant ainsi une meilleure homogénéisation de la soudure et donc une meilleure qualité de cette dernière. La soudure à l'acétylène permet l'assemblage de métaux variés (aciers, inox, alliages de cuivre), mais aussi sous certaines conditions l'aluminium allié au silicium ;
- l'acétylène est également utilisé dans les chalumeaux oxy-coupeur. Cependant, le propane lui est préféré, car moins couteux.
- la réaction de l’acétylène avec l’acide chlorhydrique est une manière de produire du chlorure de vinyle (monomère du chlorure de polyvinyle).
Production et synthèse
L’acétylène n’existe pas à l'état naturel (d'autres alcynes existent ponctuellement dans les hydrocarbures). Les principales méthodes industrielles pour produire l’acétylène sont :
Méthode carbochimique
On utilise comme matière première le calcaire et le coke ou du charbon de bois. Dans un four à haute température (1 700 °C minimum) chauffé par un courant électrique passant dans le milieu réactionnel en fusion, il se produit du carbure de calcium selon les réactions :
-
- CaCO3 → CaO + CO2
-
- CaO + 3 C + 108 300 calories → CaC2 + CO
Chez l’utilisateur, le carbure réagit avec l’eau pour produire l’acétylène.
-
- CaC2 + 2 H2O → C2H2 + Ca(OH)2 + 31 000 calories
Combustion partielle du méthane
La combustion partielle du méthane produit aussi de l’acétylène :
-
- 3 CH4 + 3 O2 → C2H2 + CO + 5 H2O
Déshydrogénation des alcanes
Les alcanes les plus lourds du pétrole et du gaz naturel sont craqués en molécules plus légères qui sont deshydrogénées à haute température.
-
- C2H6 → C2H2 + 2 H2
Propriétés physico-chimiques
Les propriétés chimiques de l'acétylène s'expliquent en grande partie par la présence dans sa molécule d'une triple liaison résultant de la superposition d'une liaison simple s (provenant de la fusion de deux orbitales sp) et de deux liaisons p résultant de la fusion de deux orbitales 2p. Cette liaison, de longueur 0,124 nm et caractérisée par une énergie de 811 kJ, est moins stable que les liaisons simples (614 kJ) et doubles (347,3 kJ), et par conséquent plus réactive.
Les réactions de l’acétylène
- L’acétylène et les monoalkylacétylènes sont les seuls hydrocarbures qui ont un hydrogène ayant un caractère acide et qui peut être échangé par un métal.
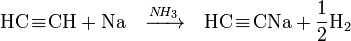
- Certains acétylénures comme
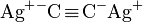
- L’acétylène réagit avec l’acide cyanhydrique pour former de l’acrylonitrile, monomère de l’acrylonitrile butadiène styrène (ABS) et du styrène-acrylonitrile (SAN).
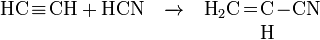
- L'acétylène donne le benzène par polymérisation sous l'action de la chaleur.
- Par dimérisation en présence de catalyseurs, on obtient du vinylacétylène auquel on ajoute du chlorure d'hydrogène pour obtenir du chloroprène, monomère du polychloroprène ou néoprène.


















































