Acétylacétone - Définition
La liste des auteurs de cet article est disponible ici.
Autres réactions avec l'acétylacétone
Parmi les autres réactions impliquant l'acétylacétone, on peut citer :
- les déprotonations : des bases très fortes déprotoneront l'acétylacétone doublement, démarrant en C3 et mais aussi en C1. Les espèces résultantes peuvent être ensuite alkylées en C-1.
- comme précurseur pour hétérocycles : l'acétylacétone est un précurseur versatile pour les hétérocycles. L'hydrazine réagit pour donner des pyrazols, l'urée donne des pyridimines.
- comme précurseur pour les imino-ligands liés : l'acétylacétone se condense avec les amindes pour donner, de manière successive, les mono- et di-dicétimines dans lesquelles les atomes d'oxygène dans l'acétylacétone sont remplacés par NR (ou R = aryl, alkyl).
- dépression enzymatique : l'enzyme acétylacétone dioxygénase coupe la liaison carbone-carbone de l'acétylacétone, produisant ainsi de l'acétate et le 2-oxopropanal. L'enzyme est dépendante au Fe (II), mais il a cependant été prouvé qu'elle pouvait lier aussi le zinc. La dégradation de l'acétylacétone a été caractérisée pour la bactérie Acinetobacter johnsonii.
- C5H8O2 + O2 → C2H4O2 + C3H4O2
- Arylation : l'acétylacétonate déplace les halogénures depuis certains acides benzoïques halogéno-substitués. Cette réaction est catalysée par le cuivre.
- 2-BrC6H4CO2H + NaC5H7O2 → 2-(CH3CO)2HC)-C6H4CO2H + NaBr
Chimie de coordination
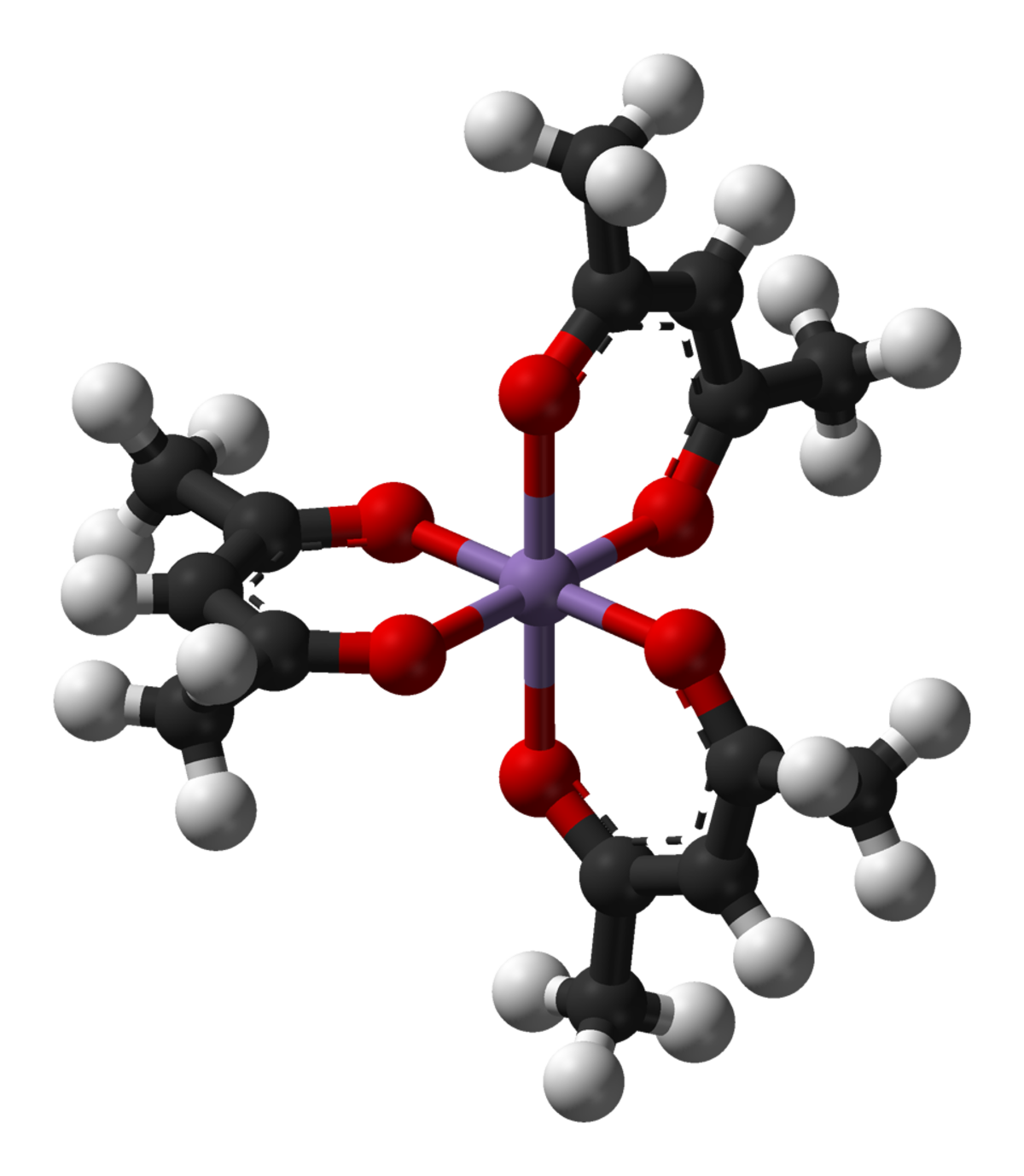
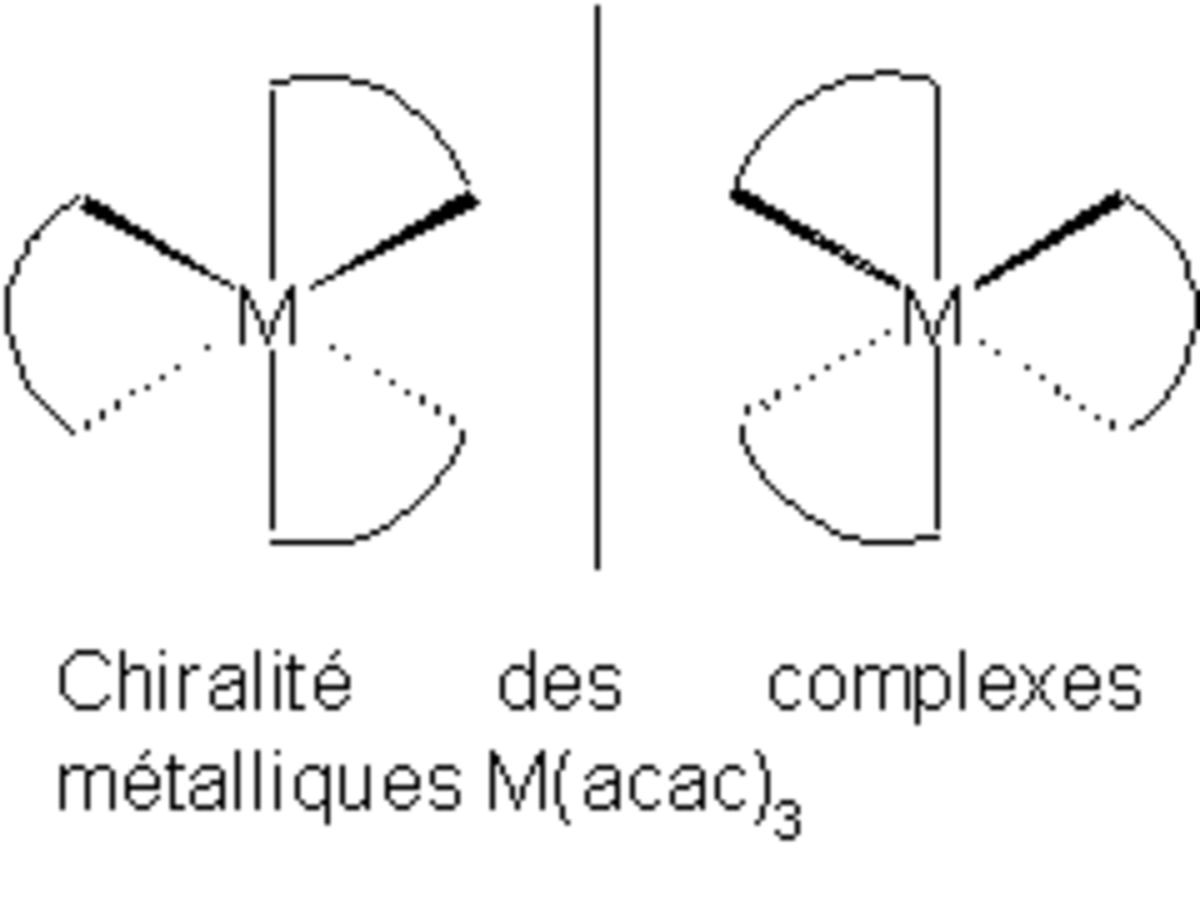
L'anion acétylacétonate forme des complexes avec de nombreux ions de métaux de transition dans lesquels les deux atomes d'oxygène se lient au métal pour former un anneau de chélation à six membres. On peut citer parmi ces complexes : Mn(acac)3, le VO(acac)2, Fe(acac)3, et Co(acac)3. Tout complexe de la forme M(acac)3 est chiral (ils ne sont pas superposables à leurs images dans un miroir), comme indiqué sur la figure 2.
De plus, les complexes M(acac)3 peuvent être réduits par voie électrochimique, avec un taux de réduction dépendant du solvant et du centre métallique. Les complexes double ou triple du type M(acac)2 et M(acac)3 sont typiquement solubles dans des solvants organiques, contrairement aux halogénures de métaux liés. En raison de ces propriétés, ces complexes sont très largement utilisés comme précurseurs ou réactifs de catalyse. Les applications les plus importantes incluent leur utilisation en tant que « réactifs de déplacement » RMN, comme catalyseurs pour les synthèses organiques, et comme précurseurs pour les catalyseurs d'hydroformylation.
C5H7O2− se lie parfois aux métaux par son atome de carbone central; ce mode de liaison est plus commun pour les métaux de transition de la troisième période comme le platine (II) ou l'iridium (III).
Exemples d'acétylacétonates de métaux
Acétylacétonate de cuivre II
Le Cu(acac)2, préparé par traitement de l'acétylacétone avec du Cu(NH3)42+ et disponible dans le commerce, catalyse les réactions de couplage et de transferts de carbènes.
Acétylacétonate de cuivre I
Contrairement au chélate de cuivre II, l'acétylacétonate de cuivre I est une espèce oligomérique réactive à l'air. Il est employé pour catalyser les réactions de Michaels.
Acétylacétonate de manganèse III
Mn(acac)3, oxydant monoélectronique, est communément utilisé pour le couplage des phénols. Il est préparé par réaction directe de l'acétylacétone et du permanganate de potassium. En termes de structure électronique, Mn(acac)3 est un composé haut-spin. Sa structure octaédrique distordue traduit les distorsions géométriques dues à l'effet Jahn-Teller. Les deux structures les plus communes de ce complexe sont les suivantes : une avec une élongation quadratique, l'autre avec une compression quadratique. Dans l'élongation, deux liaisons Mn-O mesurent 2,12 Å alors que les quatre autres mesurent 1,93 Å. Dans le cas de la compression , deux liaisons Mn-O mesurent 1,95 Å alors que les quatre autres mesurent 2,00 Å. Les effets de l'élongation quadratique sont plus signicatifs que les effets de la compression quadration.
Acétylacétonate de nickel
Ce composé n'est pas le composé de formule Ni(acac)2, mais le trimère [Ni(acac)2]3. C'est un solide vert émeraude soluble dans le benzène, qui est très utilisé dans la préparation des complexes Ni(O). Exposé à l'atmosphère, [Ni(acac)2]3 se transforme en l'hydrate monomère vert crayeux.
Acétylacétonates à liaisons carbone
C5H7O2− se lie parfois aux métaux par le carbone central (C3) : ce mode de liaison est plus courant pour les métaux de transitions de la troisième période comme le platine (II) et l'iridium (III). Les complexes Ir(acac)3 et les bases de Lewis adduites correspondantes Ir(acac)3L (ou L est une amine) comprennent un ligand acac carbone-lié. Le spectre infrarouge des acétylacétonates oxygène-liés sont caractérisés par des bandes νCO d'énergie relativement basse (1 535 cm-1), alors que dans les acétylacétonates carbone-liés, la vibration du carbonyle se produit plus près de la gamme d'énergie pour le C=O cétonique, c'est-à-dire à 1 655 cm-1.