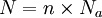Masse atomique - Définition
La masse atomique (ou masse molaire atomique) d'un isotope d'un élément chimique est la masse relative d'un atome de cet isotope ; la comparaison est faite avec le carbone 12 dont la masse atomique est fixée à 12 unités. La masse atomique est un nombre sans dimension qui est assez proche du nombre de nucléons dans le noyau de l'atome. La masse atomique du carbone correspond à la masse de 6.02
ou
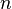
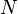
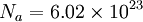
La masse atomique est en fait la masse d'une mole d'un élément chimique donné, exprimée en unité de masse atomique unifiée (symbole u ou uma )
La masse atomique est également définie pour un élément chimique, c'est alors la moyenne pondérée des masses atomiques des isotopes au prorata de la fréquence de ces isotopes tels qu'on les trouve dans la nature.
Différentes références de masse
- 1805 : John Dalton fixe la masse atomique de l'hydrogène à 1
- 1865 : Jean Stas fixe la masse atomique de l'oxygène 16 à 16
- 1961 : L'Union internationale de chimie pure et appliquée tranche pour la définition actuelle de la masse atomique