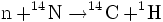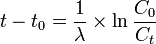Datation au carbone 14 - Définition
La datation au carbone 14 est une méthode de datation radiométrique basée sur la mesure de l'activité radiologique du carbone 14 contenu dans de la matière organique dont on souhaite connaître l'âge absolu, à savoir le temps écoulé depuis sa mort.
Le domaine d'utilisation de cette méthode correspond à des âges absolus de quelques centaines d'années jusqu'à environ 50 000 ans. L'application de cette méthode à des événements anciens, tout particulièrement lorsque leur âge dépasse 6 000 ans (préhistoriques), a permis de les dater beaucoup plus précisément qu'auparavant. Elle a ainsi apporté un progrès significatif en archéologie et en paléoanthropologie.
Historique
En 1960, Willard Frank Libby a reçu le prix Nobel de chimie pour le développement de cette méthode (cf. article sur le chercheur pour l'histoire de cette découverte).
Principe de la datation
Le carbone 14 (14C) ou radiocarbone est un isotope radioactif du carbone dont la période radioactive (ou demi-vie) est égale à 5 730 ans.
Un organisme vivant assimile le carbone sans distinction isotopique. Durant sa vie, la proportion de 14C présent dans l'organisme par rapport au carbone total (12C, 13C et 14C) est la même que celle existant dans l'atmosphère du moment.
La datation au carbone 14 se fonde ainsi sur la présence dans tout organisme de radiocarbone en infime proportion (de l'ordre de 10-12 pour le rapport 14C/C total). À partir de l'instant où un organisme meurt, la quantité de radiocarbone qu'il contient ainsi que son activité radiologique décroissent au cours du temps selon une loi exponentielle. Un échantillon de matière organique issu de cet organisme peut donc être daté en mesurant soit le rapport 14C/C total avec un spectromètre de masse, soit son activité x années après la mort de l'organisme.
Origine du radiocarbone naturel
Le radiocarbone naturel circule dans trois réservoirs : l'atmosphère, les océans et la biosphère.
Avec une période radioactive de 5 730 ans, le radiocarbone aurait depuis longtemps disparu de la biosphère s’il n’était produit en permanence.
Dans la haute atmosphère, des réactions nucléaires avec les protons du rayonnement cosmique produisent des neutrons. Après avoir été ralentis par collision avec les molécules de l'air, les neutrons réagissent avec l'azote pour former du radiocarbone :
Cette réaction est privilégiée du fait que l’azote constitue 78,11 % de l’atmosphère de la terre. C’est entre 7000 mètres et 12 000 mètres que la production de radiocarbone a lieu.
Le radiocarbone réagit rapidement avec l'oxygène pour former du dioxyde de carbone. Ce gaz circule dans toute l'atmosphère et se dissout dans les océans pour former des carbonates. Du radiocarbone circule donc aussi dans les océans.
Le dioxyde de carbone réagit également avec la biosphère. Les plantes assimilent du radiocarbone dans l'atmosphère par photosynthèse et elles sont mangées par les animaux. Les organismes marins assimilent également le radiocarbone présent dans les océans. Le radiocarbone se répand donc dans la biosphère tout au long de la chaîne alimentaire.
Le rapport 14C/C total est considéré comme uniforme dans l'atmosphère, la surface des océans et la biosphère en raison des échanges permanents entre les organismes vivants et leur milieu.
De plus, on suppose que le flux de rayons cosmiques est constant sur une longue période de temps (première approximation). Par conséquent, le taux de production du radiocarbone est constant, donc le rapport 14C/C total dans l’atmosphère, la surface des océans et la biosphère est constant (le nombre d’atomes produits égale le nombre d’atomes qui se désintègrent).
À la mort d'un organisme, tout échange avec le milieu extérieur cesse mais du radiocarbone reste piégé et sa quantité se met à décroître exponentiellement selon le processus de la décroissance radioactive : ceci permet de savoir depuis combien de temps l'organisme est mort.
Mesure de l’âge d’un échantillon de matière organique
La désintégration radioactive du carbone 14 obéit à une loi de décroissance exponentielle caractérisée par sa demi-vie. Dater un échantillon de matière organique consiste à mesurer le rapport 14C/C total (ce qui reste de radiocarbone naturel suite à la désintégration) et à en déduire son âge. Le rapport 14C/C total est mesuré soit indirectement par la mesure de l'activité spécifique (nombre de désintégrations par unité de temps et par unité de masse de carbone) due au radiocarbone naturel qui est proportionnelle au rapport 14C/C total, soit directement par spectrométrie de masse.
Quand elle fut mise au point par Libby à la fin des années 1940, la datation au carbone 14 passait par la mesure de la radioactivité des échantillons ce qui était délicat du fait de la faiblesse du signal (il y a peu d’atomes de radiocarbone dans l’échantillon analysé, surtout après quelques milliers d’années, et encore moins qui se désintègrent) et du bruit de fond (radioactivité naturelle, rayons cosmiques...)
Aujourd’hui, la mesure directe du rapport 14C/C total par spectrométrie de masse est privilégiée car elle permet de dater des échantillons beaucoup plus petits (moins d’un milligramme contre plusieurs grammes de carbone auparavant) et beaucoup plus vite (en moins d’une heure contre plusieurs jours ou semaines). Le carbone extrait de l'échantillon est d'abord transformé en graphite, puis en ions qui sont accélérés par la tension générée par un spectromètre de masse couplé à un accélérateur de particules. Les différents isotopes du carbone sont séparés grâce à un aimant ce qui permet de compter les ions de carbone 14.
Les échantillons vieux de plus de 50 000 ans ne peuvent être datées au carbone 14 car le rapport 14C/C total est trop faible pour être mesuré par les techniques actuelles ; les résultats ne sont relativement précis que pour les âges inférieurs à 35 000 ans
La méthode la plus courante de datation consiste à déterminer la concentration Ct de radiocarbone (c’est-à-dire le rapport 14C/C total) d'un échantillon à l'instant t de mesure ; l'âge de l'échantillon est alors donné par la formule :
où C0 est la concentration de radiocarbone de l'échantillon à l'instant t0 de la mort de l'organisme d'où provient l'échantillon (
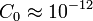
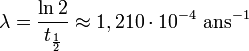
Période radioactive conventionnelle
L'âge carbone 14 conventionnel d'un échantillon de matière organique est calculé à partir d'une période conventionnelle de 5 568 ans, calculée en 1950 à partir d’une série de mesures. Depuis, des mesures plus précises ont été réalisées, et donnent une période de 5 730 ans mais les laboratoires continuent à utiliser la valeur conventionnelle pour éviter les confusions.
Les résultats sont donnés en années " before present " (BP). Le point zéro (à partir duquel est mesuré le temps écoulé depuis la mort de l'organisme dont cette matière est issue) est fixé à 1950, en supposant un niveau de radiocarbone égal à celui de 1950 car depuis la pollution a grandement modifié le taux atmosphérique du dioxyde de carbone !
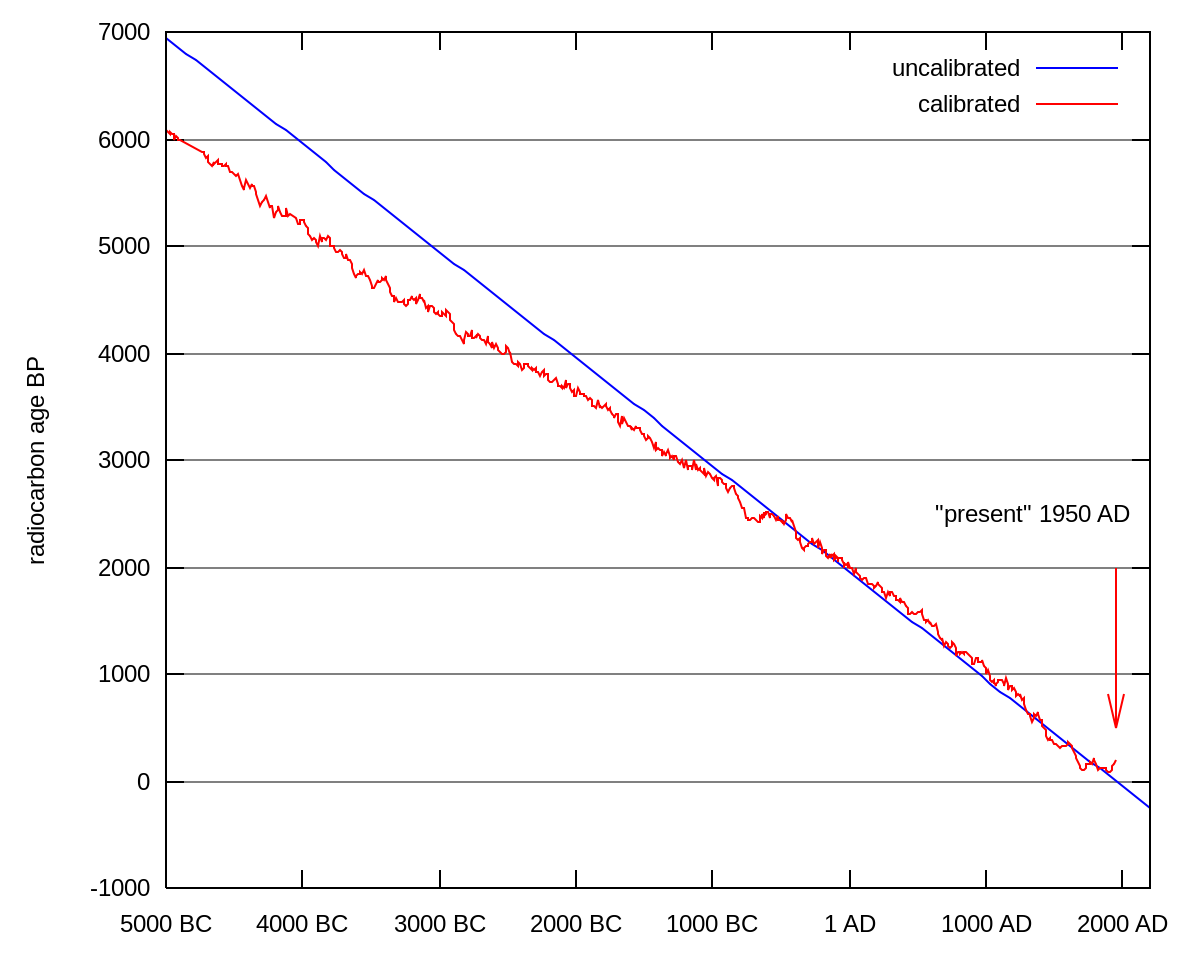
Courbes d’étalonnage
Au début des années 1960, certaines divergences systématiques observées entre l'âge d'échantillons estimé par la datation au carbone 14 et par l'archéologie ou la dendrochronologie posent problème.
Même si le flux de rayons cosmiques à l'origine de la formation du 14C peut être supposé constant, la recherche spatiale a mis en évidence que la quantité de ce flux reçu dans la haute atmosphère terrestre variait suite aux évolutions du champ magnétique terrestre et du champ magnétique solaire. Ceci explique que le taux de production du radiocarbone naturel ait varié au cours du temps.
Les changements climatiques ainsi que le rejet massif de carbone fossile dans l’atmosphère par l’industrie et les transports ont également modifié la quantité totale de carbone dans les trois réservoirs (atmosphère, océans et biosphère). Enfin, durant les années 1950 et 1960, les essais nucléaires ont presque doublé la quantité de radiocarbone dans l’atmosphère. Toutefois ces phénomènes récents n'ont pas d'impact sur la datation d'objets anciens, dont le rapport 14C/C ne dépend que de leur âge, et du taux 14C/C à la date de leur arrêt d'activité biologique.
En conclusion, le rapport 14C/C total dans la biosphère n'est pas constant dans le temps. Il est donc nécessaire de construire des courbes d'étalonnage en confrontant les datations obtenues grâce au carbone 14 et les datations par d’autres méthodes telles que la dendrochronologie.
Ces courbes permettent, connaissant l'âge carbone 14 conventionnel d’un échantillon, de trouver la date correspondante dans notre calendrier.
Autres corrections
Les véhicules équipés de moteurs à combustion interne utilisent des produits pétroliers qui ne contiennent que des isotopes stables du carbone, 12C et 13C ; la totalité du carbone 14 ayant disparu au cours de la longue durée d'enfouissement des combustibles fossiles.
Ce sera également le cas des gaz carbonés rejetés par ces véhicules ; ainsi, la datation au 14C d'un arbuste poussant en bordure des autoroutes pourra fréquemment lui attribuer un âge de douze mille ans ou plus.
Des tables de correction existent donc pour permettre des datations liées à la révolution industrielle, en fonction des lieux d'émissions de gaz carbonés dépourvus en 14C, issus de combustibles fossiles.