Acétone - Définition
|
Général |
|
|---|---|
| Nom | Acétone |
| formule chimique | C3H6O |
| Poids moléculaire | 58,08 uma |
| Synonymes | Propan-2-one, β-cétopropane, Diméthyl cétone |
| numéro CAS | 67-64-1 |
| numéro AN | 1090 |
|
comportement de phase |
|
| point de fusion | 178,2 K (-94,9°C) |
| point d'ébullition | 329,4 K (56,3 °C) |
| point triple | 178,5 K (-94,5 °C)
? bar |
| point critique | 508 K (235 °C)
48 bar |
| ΔfusH | 5,7 kJ/mol |
| ΔfusS | 32,3 J/mol·K |
| ΔvapH | 31,3 kJ/mol |
| Solubilité | soluble dans l'eau |
|
propriétés du liquide |
|
| ΔfH0liquid | -249,4 kJ/mol |
| S0liquid | 200,4 J/mol·K |
| Cp | 125.5 J/mol·K |
| Densité | 0,79 |
|
propriétés du gaz |
|
| ΔfH0gas | -218.5 kJ/mol |
| S0gas | J/mol·K |
| Cp | 75 J/mol·K |
|
Sécurité |
|
| effets aigus | dépression du système nerveux central. Dommages au foie et aux reins. Arrêt respiratoire. |
| effets chroniques | |
| point d'éclair | < -20°C |
| Température d'auto-inflammation | 540 °C |
| limites d’explosivité dans l'air | 2,6-13% |
|
Plus d’infos |
|
| Propriétés | NIST WebBook |
| MSDS | Hazardous Chemical Database |
|
Les unités SI sont utilisées sauf indication contraire, aux pressions et températures normales. |
|
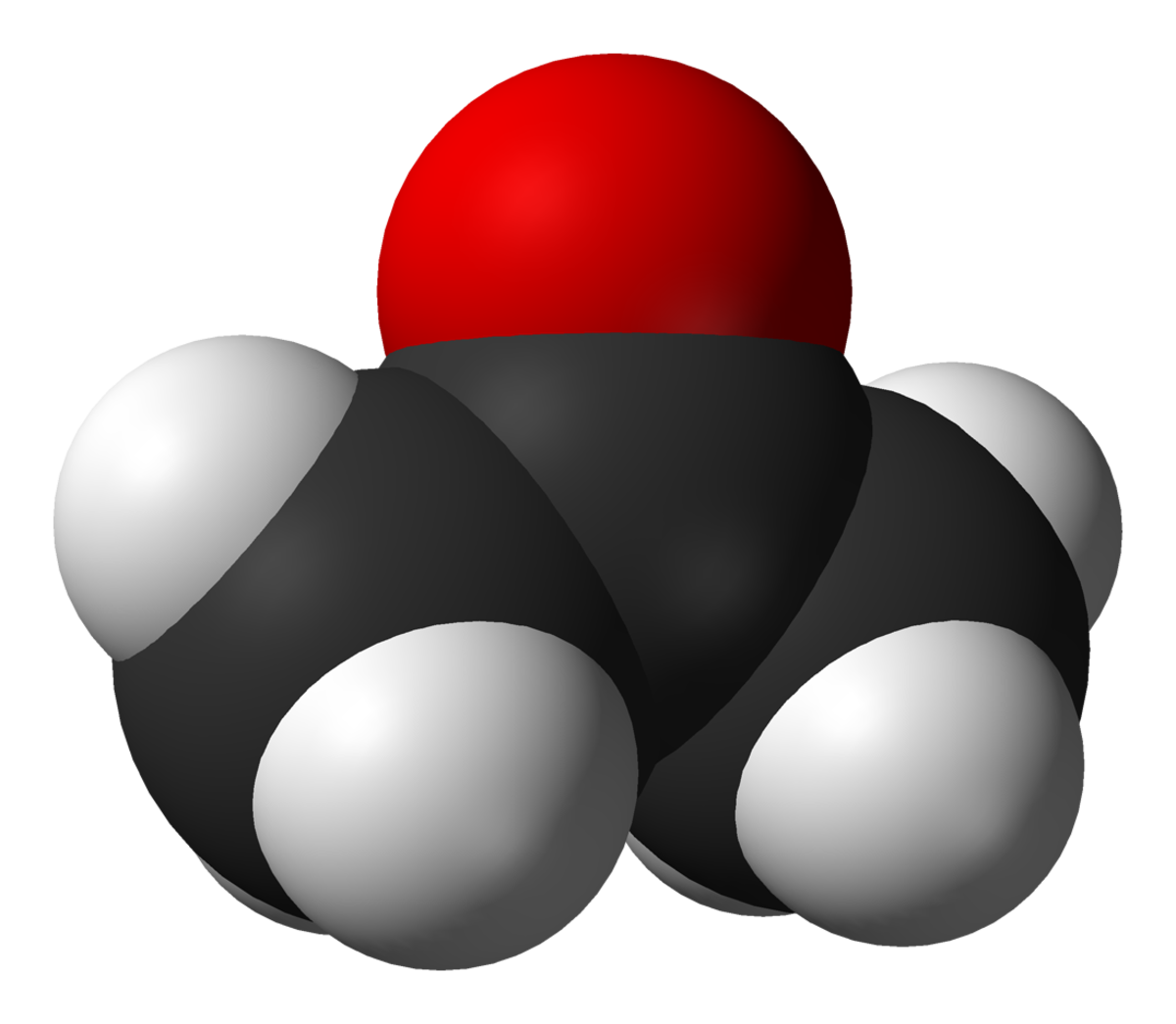
L’acétone en chimie, (aussi connue sous les noms de diméthylcétone, 2-propanone, propan-2-one et béta-cétopropane ou simplement propanone), de formule chimique CH3COCH3 est le composé le plus simple de la famille des cétones. C'est un isomère du propanal.
Chimie
L’acétone est un liquide transparent, inflammable, d'odeur caractéristique (plutôt fruitée). La température de fusion est de -95,4 °C et celle d'ébullition de 56,53 °C. Il a une densité relative de 0,819 (à 0 °C). C'est un composé très soluble dans l'eau (c'est une molécule polaire à chaîne carbonée courte), l'éthanol, l'éther, etc. L'acétone est le dérivé le plus simple de la série des cétones aliphatiques et la présence de la double liaison carbone-oxygène lui confère l'essentiel de sa réactivité.
L'acétone forme un hydrazone avec la phénylhydrazine et un oxime avec l'hydroxylamine. Une réduction par amalgame de sodium la convertit en alcool isopropylique; une oxydation par l'acide chromique donne de l'oxyde de carbone, et de l'acide acétique. Elle réagit avec l’ammoniaque pour former du di- et tri-acétoneamines. Elle s'unit aussi directement avec le cyanure d'hydrogène pour former le nitrile d’acide α-oxyisobutyrique.
Par l’action de divers réactifs, comme la chaux, la potasse caustique ou l'acide chlorhydrique, etc., l'acétone est convertie en produits de condensation, en oxyde mésityle C6H10O, en phorone C9H14O, etc.
Elle est convertie en mésitylène C9H12 (trimétylbenzène symétrique) par distillation en présence d'acide sulfurique (H2SO4). L’acétone a aussi été utilisée pour la production de teinture d’indigo artificiel. En présence d’iode et d'un alcali elle donne le iodoforme.
Fabrication
L'acétone, extraite autrefois du pyroligneux résultant de la carbonisation du bois, a été ensuite un produit dérivé de l'acide acétique.
En 1915, Chaim Weizmann découvrit un moyen peu coûteux d’obtenir de l’acétone à partir de l’amidon, ce qui facilita la production de cordite, un explosif. Il le négocia avec le gouvernement de la Grande-Bretagne pour obtenir la création de l’état d’Israël, dont il deviendra le premier président.
La méthode la plus utilisée actuellement pour produire l'acétone est le procédé Cumène, qui permet de la fabriquer (ainsi que le phénol) à partir de benzène et de propène. La production mondiale d'acétone est de l'ordre de 1,5 millions de tonnes par an.
Utilisation
L'acétone est un solvant très utilisé dans l'industrie et en laboratoire. C'est également un composé à la base de la fabrication de plastiques, de médicaments, et autres produits chimiques. L'acétone est notamment utilisée dans l'industrie pour produire le bisphénol A par réaction avec le phénol (le bisphénol A est un constituant important de nombreux polymères de type polycarbonates ou polyuréthanes ainsi que de résines époxys. Elle est également utilisée à grande échelle pour le transport et le stockage de l'acétylène: un récipient contenant un matériau poreux est rempli d'acétone, dans laquelle l'acétylène est ensuite dissout. Un litre d'acétone permet de dissoudre environ 250 litres d'acétylène.
L'acétone est également le principal constituant du dissolvant utilisé pour retirer le vernis à ongles. Elle est également utilisée comme dissolvant pour dissoudre la colle et les fibres cellulosiques. Il est recommandé de ne pas utiliser d'acétone sur les fibres artificielles (acétate, triacétate et acrylique).
Des bains d'acétone sont utilisés pour la préparation des corps lors de la plastination.
Aspect biologique
L'acétone est une cétone corporelle, présente normalement, en très petites quantités, dans l'urine et dans le sang. De plus grandes quantités peuvent être trouvées après un jeûne et chez les patients diabétiques avec une déficience en insuline sévère (ce sont des personnes non traitées ou incorrectement); une odeur fruitée de l’haleine causée par l'acétone est l'un des symptômes de la cétoacidose diabétique.
L'acétone existe naturellement dans les plantes, les arbres, gaz volcaniques, feux de forêts et comme un produit de la décomposition du gras animal. Elle est présente dans la fumée des véhicules, du tabac et des décharges. Les activités humaines en produisent plus que la nature.
On le trouve parmi les produits formés par la distillation destructive du bois, sucre, cellulose, etc. et pour cette raison il est toujours présent dans l’esprit de bois brut, dont une grande proportion peut être récupérée par distillation fractionnée.
Effets sur la santé et sécurité
Le contact avec l'acétone peut provoquer des irritations ou des dégâts à la peau. Une exposition importante et prolongée peut entraîner une perte de conscience.
Des études sur animaux de laboratoire ont démontré des dommages aux reins, au foie et aux nerfs, ainsi qu'au fœtus en cas d'exposition prolongée à des doses importantes d'acétone. Les animaux mâles montraient également de l'incapacité à se reproduire. On ne sait pas si ce genre d'effets peut être observé chez l'homme.
Des doses millimolaire non toxiques d'acétone montrent un effet anticonvulsant dans des modèles animaux d'épilepsie (Likhodii et al, 2003).
La valeur limite d'exposition professionnelle est fixée à 500 ppm (1210 mg/m3) dans l'Union européenne
Phrases de risque et conseils de prudence selon la fiche internationale
- R: 11 (Facilement inflammable)
- S: 2 (Conserver hors de la portée des enfants)
- S: 9 (Conserver le récipient dans un endroit bien ventilé)
- S: 16 (Conserver à l’écart de toute flamme ou source d’étincelles. Ne pas fumer)
- S: 23 (Ne pas respirer les vapeurs)
- S: 33 (Eviter l’accumulation de charges électrostatiques)
Phrases de risque et conseils de prudence selon l'INRS
Régles Etiquetage
- R: 11 (Facilement inflammable)
- R: 36 (Irritant pour les yeux)
- R: 66 (L’exposition répétée peut provoquer dessèchement ou gerçures de la peau)
- R: 67 (L’inhalation de vapeurs peut provoquer somnolence et vertiges)
- S: 9 (Conserver le récipient dans un endroit bien ventilé)
- S: 16 (Conserver à l’écart de toute flamme ou source d’étincelles. Ne pas fumer)
- S: 26 (En cas de contact avec les yeux, laver immédiatement consulter un ophtalmologiste)