Acide faible - Définition
Définition
Un acide faible est un acide qui ne se dissocie pas totalement dans l'eau : lorsqu'un acide faible AH est mis en présence d'eau, la réaction suivante a lieu :
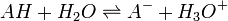
La réaction n'est pas totale mais équilibrée. (

On classe les acides faibles en fonction de leur constante d'acidité, c'est-à-dire en fonction de leur capacité à plus ou moins se dissocier en présence d'eau. On estime qu'un acide est faible lorsque son pKa est supérieur à 0. Un acide est d'autant plus faible que son pKa est élevé. Sa base conjuguée est donc d'autant plus forte et stable que ce même pKa est élevé.
Exemples d'acides faibles
L'acide méthanoïque, l'acide éthanoïque et les autres acides carboxyliques sont des acides faibles.

















































