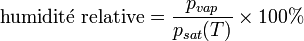Pression de vapeur saturante - Définition
La pression de vapeur saturante ou tension de vapeur est la pression à laquelle la phase gazeuse de cette substance est en équilibre avec sa phase liquide ou solide. Elle dépend de la température. Certains utilisent le terme " pression de vapeur ", mais celui-ci est ambigu car il évoque la pression partielle de la vapeur.
La pression de vapeur saturante est la pression partielle de la vapeur d'un corps pur à partir de laquelle une partie du corps pur passe sous forme liquide ou solide. On dit aussi que c'est la pression maximale de sa vapeur " sèche " (c'est-à-dire sans phase liquide).
Quand la pression partielle de la vapeur est égale à la pression de vapeur saturante d'une substance, les phases gazeuse,liquide ou solide sont en équilibre.
Si la pression partielle de la vapeur dépasse la pression de vapeur saturante, il y a donc liquéfaction ou condensation. À partir d'une situation d'équilibre, cela peut se faire en augmentant la pression partielle de vapeur (par exemple en diminuant le volume), ou bien en diminuant la pression de vapeur saturante, c'est-à-dire en diminuant la température.
Historique
Au XIXe siècle, John Dalton étudia le volume de vapeur d'eau qui était nécessaire pour saturer l'air. Il remarqua que ce volume dépendait beaucoup de la température.
Cas de corps pur liquides
Lorsqu'à l'équilibre on a un corps pur sous forme liquide avec un " ciel " gazeux (atmosphère au-dessus du liquide) fait du même corps pur, une partie de l'atmosphère est composée du corps pur sous forme gazeuse ; la contribution à la pression de cette fraction (ou pression partielle du corps pur gazeux) est la pression de vapeur saturante. Si alors la pression passe en dessous de la pression de vapeur saturante (par une détente, ou alors en augmentant la pression de vapeur saturante, c'est-à-dire en chauffant), le liquide passe violemment sous forme gazeuse : c'est la vaporisation, ou ébullition.
Si cette vapeur est mélangée avec d'autres gaz, on considère que la pression partielle saturante de vapeur est la même que la pression d'équilibre de la vapeur seule. On peut avoir le cas où la pression de vapeur saturante est supérieure à la pression partielle du gaz, mais inférieure à la pression totale : le liquide passe alors lentement sous forme gazeuse, c'est l'évaporation. Il n'y a ébullition (vaporisation) que si la pression de vapeur saturante est supérieure à la pression totale.
Ainsi, pour une pression donnée, le point d'ébullition d'une substance est la température à laquelle la pression de vapeur saturante de cette substance est égale à la pression ambiante totale.
À partir d'une situation d'équilibre psat(T) = pvap :
- modification de la température ambiante :
- en dessous de cette température, la vapeur se liquéfie ;
- au-dessus de cette température, le liquide s'évapore, et au dessus du point de fusion, il se vaporise (il bout).
- modification de la pression ambiante :
- au-dessus de cette pression, la vapeur se liquéfie en liquide ;
- en dessous de cette pression, le liquide s'évapore, et pour les très basses pressions, il se vaporise (il bout) ; la pression limite d'ébullition est celle pour laquelle le point d'ébullition est la température actuelle.
En résumé :
- psat(T) > pamb : ébullition, vaporisation
- pamb > psat(T) > pvap : évaporation
- psat(T) = pvap : équilibre
- pvap > psat(T) : liquéfaction
où psat(T) est la pression de vapeur saturante, pvap est la pression de vapeur (pression partielle de la vapeur) et pamb est la pression ambiante.
Par exemple, une flaque d'eau s'évapore au Soleil (la pression de vapeur saturante de l'eau est supérieure à la pression partielle de la vapeur mais inférieure à la pression atmosphérique). Lorsque l'on porte une casserole d'eau à 100 °C sous une atmosphère, l'eau bout (la pression de vapeur saturante excède la pression atmosphérique). Dans une bouteille de gaz liquéfié (type propane ou butane), le gaz bout à froid dans la bouteille au fur-et-à-mesure que l'on soutire du gaz (au cours du soutirage, la pression totale devient inférieure à la pression de vapeur saturante).
Mélange de corps purs
La loi de Raoult régit approximativement la pression de vapeur saturante de mélanges de liquides.
Dans une enceinte de taille raisonnable de type bouteille ou réservoir de gaz, un mélange de gaz peut être considéré comme homogène : l'énergie d'agitation thermique est supérieure à la différence d'énergie potentielle de gravité, la stratification est négligeable. Ainsi, la composition du mélange est quasiment constante du début à la fin du tirage. Il peut par contre se produire une condensation sélective qui fait varier la composition du mélange (un des gaz se condense alors que l'autre reste sous forme gazeuse, ou lorsque les deux gaz sont liquéfiés la composition du liquide diffère de celle du gaz). Ainsi, les bouteilles de mélange ont une consigne de température de stockage pour assurer que la composition du gaz est bien la composition nominale.
Décompression explosive
Dans le cas d'une corps contenu dans une enceinte étanche, il peut se produire une ébullition-explosion (ou bleve) par rupture de l'enceinte lorsque :
- dans les conditions de température et de pression extérieure, le corps est sous forme gazeuse ;
- la pression est plus élevée dans l'enceinte, ce qui maintient une partie du corps sous forme liquide.
Cas d'un corps pur solide
La pression de vapeur saturante de la plupart des solides est en général très faible pour des températures " raisonnables ". Par exemple, la pression de vapeur saturante du fer à 20 °C est tellement faible qu'il est improbable d'avoir un seul atome de fer dans une pièce bien que l'acier présent soit à l'équilibre avec sa vapeur (on entre là dans des considérations quantiques de probabilité de présence).
Par ailleurs, la cohésion des atomes d'un solide fait qu'il est impensable d'avoir un phénomène d'ébullition. Toutefois, il peut se former des pores dans le matériau, et à l'intérieur de cette porosité, une partie solide passe sous forme gazeuse (avec la même précaution que ci-dessus). Cependant, ceci n'est pas lié à la pression atmosphérique comme pour les liquides (sauf pour des pressions extrêmes), mais plutôt aux propriétés du matériau, comme la présence de défauts ponctuels dans un cristal (lacunes) et la tension superficielle.
À partir d'une situation d'équilibre psat(T) = pvap
- modification de la température ambiante :
- en dessous de cette température, la vapeur se condense en solide ;
- au-dessus de cette température, le solide se sublime, c'est-à-dire qu'il se transforme directement de solide en vapeur sans passer par une phase liquide ;
- modification de la pression ambiante :
- au-dessus de cette pression, la vapeur se condense en solide ;
- en dessous de cette pression, le solide se sublime.
Ainsi, pour une pression donnée, le point de sublimation d'une substance est la température à laquelle la pression de vapeur de cette substance est égale à la pression ambiante.
On n'a donc que trois cas :
- psat(T) > pvap : sublimation
- psat(T) = pvap : équilibre
- pvap > psat(T) : condensation
Pression de vapeur saturante et autres changements de phase
La pression de vapeur saturante d'une substance en phase liquide peut être — et est généralement — différente de la pression de vapeur de cette même substance en phase solide. Si la température est telle que la pression de vapeur du liquide est supérieure à celle du solide, le liquide se vaporisera mais la vapeur se condensera en un solide, c'est-à-dire que le liquide gèlera. Si la température est telle que la pression de vapeur du liquide est inférieure à celle du solide, le solide se vaporisera mais la vapeur se condensera en un liquide, c'est-à-dire que le solide fondra.
À la température à laquelle les deux pressions de vapeur sont égales, il existe un équilibre entre les phases solides et liquides. Cette température est mentionnée comme le point de fusion.
Calcul de la pression de vapeur saturante
Le calcul approximatif de la pression de vapeur saturante peut se faire à l'aide d'une formule issue de l'équation de Clapeyron, en prenant comme hypothèses — entre autres — que la vapeur se comporte comme un gaz parfait et que l'enthalpie de vaporisation ne varie pas avec la température dans la plage considérée.
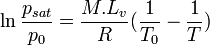
avec :
- T0 : température d'ébullition de la substance à une pression p0 donnée, en K
- psat : pression de vapeur saturante, dans la même unité que p0
- M : masse molaire de la substance, en kg/mol
- Lv : chaleur latente de vaporisation de la substance, en J/kg
- R : constante des gaz parfaits, égale à 8,31447 J/K/mol
- T : température de la vapeur, en K
Pour l'eau, par exemple :
- M = 0,018 kg/mol
- Lv = 2,26×106 J/kg
- p0 = 1013 mbar
- T0 = 373 K
Pression de vapeur saturante de l'eau dans l'air
Dans le cas de l'eau dans l'air, les manifestations de ce phénomène sont nombreuses : apparition de " vapeur " (en réalité des petites gouttelettes d'eau) au-dessus d'une casserole d'eau chaude, formation de buée, de rosée, de givre, de brouillard, de bruine ou de nuages.
La pression de vapeur saturante de l'air humide représente la quantité maximale de vapeur d'eau que l'air peut contenir. Elle augmente avec la température. On parle souvent du taux d'humidité relative de l'air : il s'agit du rapport entre la pression partielle de vapeur et la pression de vapeur saturante. Ce taux est exprimé en pourcentage.
| Température (°C) |
Pression (mbar) |
|---|---|
| -60 | 0,001 |
| -40 | 0,13 |
| -20 | 1,03 |
| -10 | 2,6 |
| 0 | 6,10 |
| 5 | 8,72 |
| 10 | 12,3 |
| 15 | 17,0 |
| 20 | 23,4 |
| 25 | 31,7 |
| 30 | 42,4 |
| 40 | 73,8 |
| 50 | 123 |
| 60 | 199 |
| 100 | 1013 |
La formule de Rankine reprend la précédente avec des coefficients légèrement différents (écart de 0,39 à 4,1 % sur la plage de 5 à 140 °C par rapport aux tables thermodynamiques) :
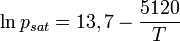
avec :
- psat : pression de vapeur saturante de l'eau, en atmosphère
- T : température absolue, en K
Pour des températures plus élevées, on pourra utiliser la formule de Duperray (écart de 0,12 à 7,7% sur la plage de 90 à 300 °C) :
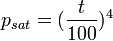
avec :
- psat : pression de vapeur saturante de l'eau, en atmosphère
- t : température, en °C
Il existe d'autres modèles comme formule de Dupré.