Eau - Définition

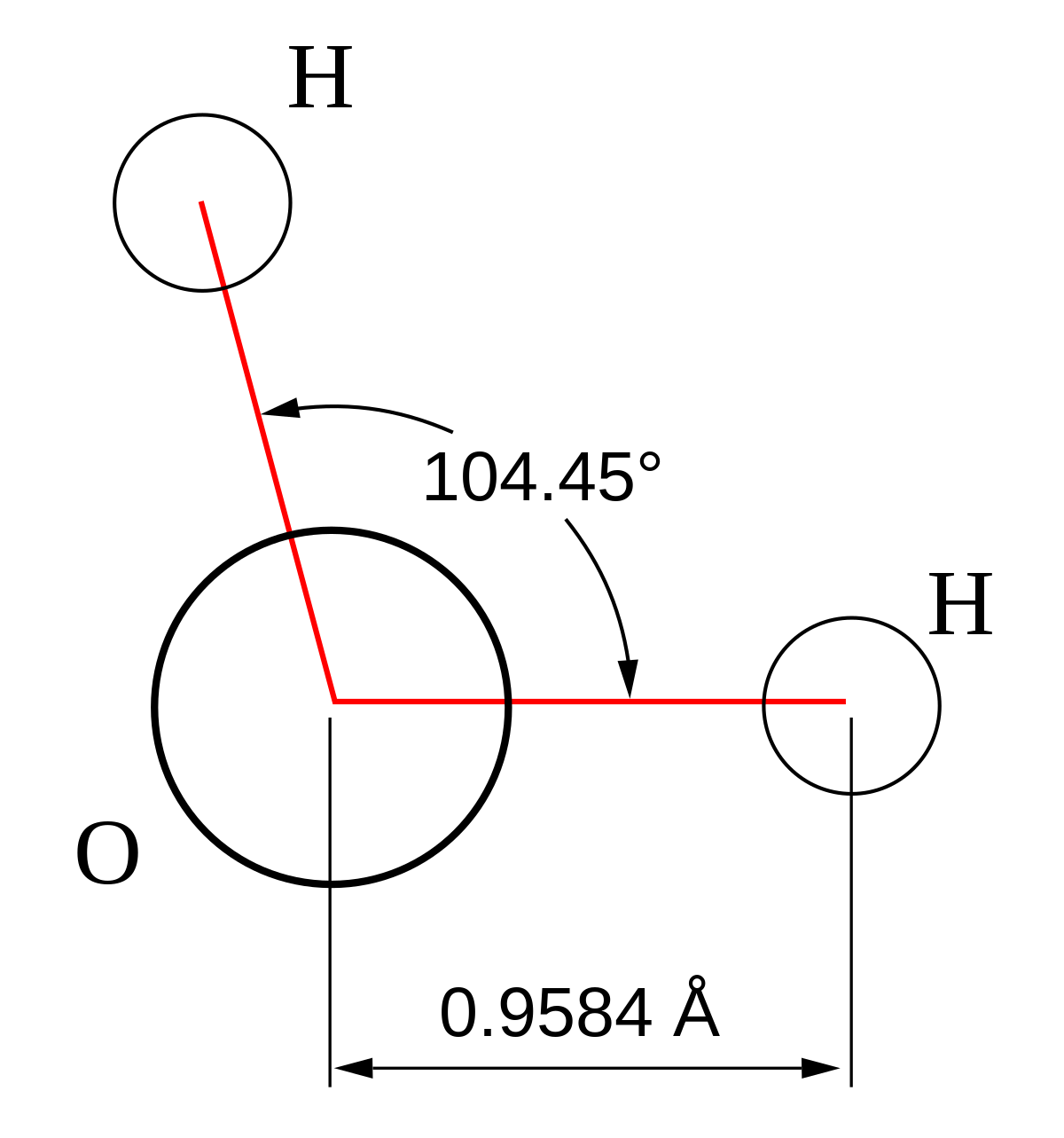
L’eau (que l'on peut aussi appeler oxyde de dihydrogène, hydroxyde d'hydrogène ou acide hydroxyque) est un composé chimique simple, mais avec des propriétés complexes à cause de sa polarisation (voir Nature dipolaire de l’eau). Sa formule chimique est H2O, c'est-à-dire que chaque molécule d'eau se compose d'un atome d'oxygène entre deux atomes d'hydrogène, disposés en V très ouvert. L'eau lourde est un composé formé d'un atome d'oxygène et de deux atomes de deutérium, qui est un isotope de l'hydrogène (oxyde de deutérium, D2O).
L’eau se trouve presque partout sur la Terre et est un composé essentiel pour tous les organismes vivants connus. Le corps humain est ainsi composé à 70 % d'eau. Par construction des êtres vivants, l’eau est pour eux (sauf exception très notable) incolore, insipide, inodore, etc.
À pression ambiante (environ un bar), l’eau est gazeuse au-dessus de 100°C, solide en dessous de 0°C, et liquide dans les conditions normales de température et de pression. C'est là une particularité essentielle : les autres composés proches ou apparentés, (sulfure d'hydrogène, ammoniac, et méthane par exemple), sont tous gazeux à des températures bien plus basses.
Près de 70 % de la surface de la Terre est recouverte d'eau (97 % d'eau salée et 3 % d'eau douce), essentiellement sous forme d'océans. Une étendue d'eau peut être un océan, une mer, un lac, un étang, un fleuve, une rivière, un ruisseau, un canal... (voir Les ressources en eau sur Terre pour plus de détails). La circulation de l’eau au sein des différents compartiments terrestres est décrite par son cycle biogéochimique.
Étymologie
Le mot eau vient du latin aqua (qui a donné par exemple : aquarium).
Origine
Selon la conception actuelle,
- L'hydrogène est produit très tôt dans l'histoire de l'univers, c'est le premier atome formé (Cf. big bang)
- L'oxygène est le produit un peu plus tardif de réaction de fusion thermonucléaire au sein de certaines étoiles.
- Ces deux atomes se combinent au cours d'une réaction exothermique pour former l’eau.
- Lorsque la Terre s'est formée, l’eau était une des molécules présentes en quantité importante (comme dans les météorites et comètes)
Physique
Propriétés générales
|
|||||
|---|---|---|---|---|---|
|
|
|||||
| Général | |||||
| Formule brute | H2O | ||||
| Nom IUPAC | 1/H2O/h1H2 | ||||
| Numéro CAS | 7732-18-5 | ||||
| Apparence | Liquide incolore | ||||
| Propriétés physiques | |||||
| Masse moléculaire | 18 g.mol − 1 | ||||
| Température de fusion |
0°C (273,15 K) | ||||
| Température de vaporisation |
100°C (373,15 K) | ||||
| Densité | 1 (liquide) | ||||
| Densité | 0,913 (solide) | ||||
| Thermochimie | |||||
| ΔfH0gas | −241,5 kJ/mol | ||||
| ΔfH0liquide | −285,8 kJ/mol | ||||
| ΔfH0solide | N/A | ||||
| Cp | pour l'eau liquide : 4,186 kJ/(kg·K) |
||||
| Cp | pour l'eau solide : 2,060 kJ/(kg·K) |
||||
| Chaleur latente de vaporisation |
2 257,92 kJ/kg | ||||
| Chaleur latente de fusion |
335 kJ/kg | ||||
| Unités du SI & CNTP, sauf indication contraire. |
|||||
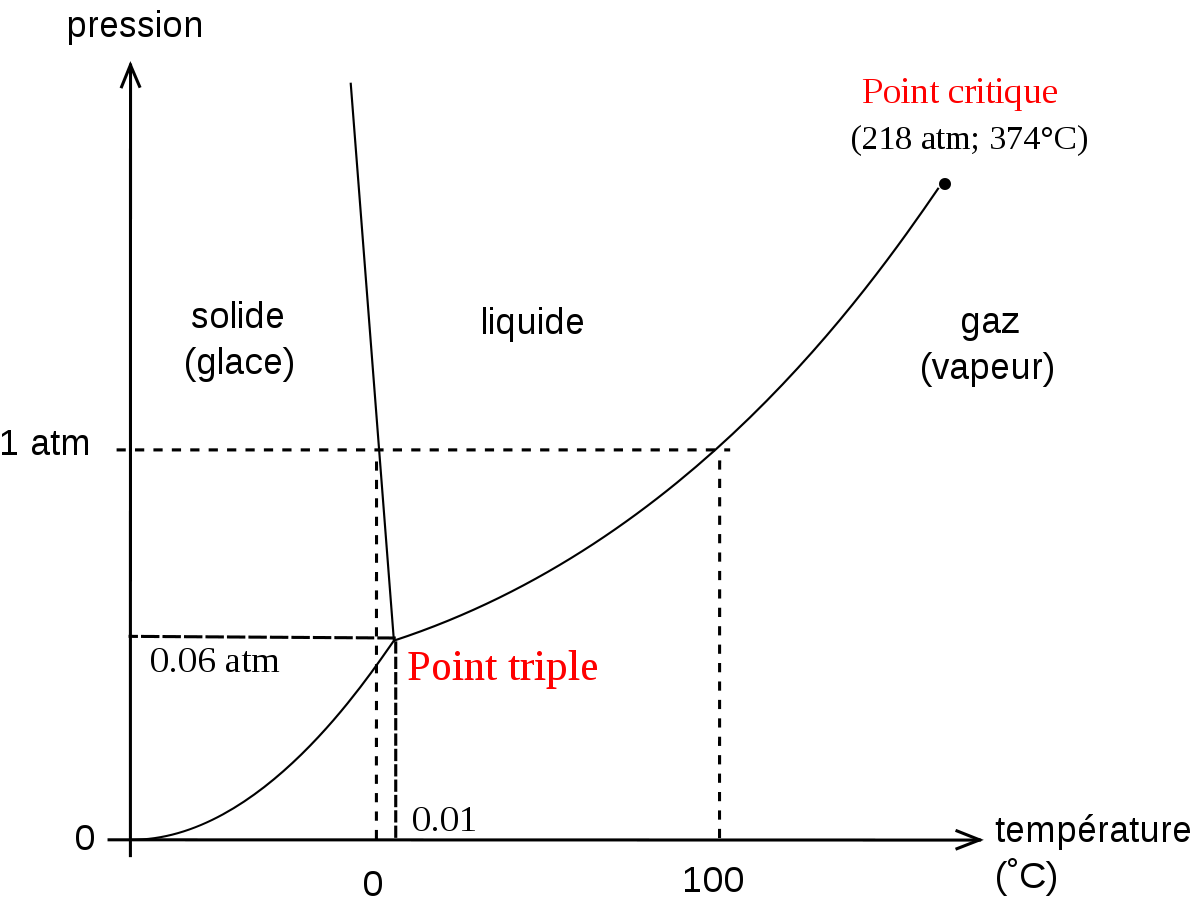
L’état solide de l'eau est la glace ; l’état gazeux est la vapeur (d’eau). Elle est totalement invisible et si on la voit s’élever au-dessus d’une casserole d’eau bouillante, c’est que le mouvement ascendant de la vapeur entraîne avec lui des minuscules gouttelettes d’eau. L’état de l’eau dépend des conditions de pression P et de température T. Il existe une situation unique (P,T) dans laquelle l’eau coexiste sous les trois formes solide, liquide, et gazeux ; cette situation est appelée " point triple de l'eau ", elle a lieu à une température de 273,16 K (0,01°C) et une pression de 611,2 Pa.
Les unités de température (anciennement les degrés Celsius, maintenant les kelvins) sont définies grâce à ce point triple de l’eau.
La vélocité du son dans l'eau est de 1 500 m/s dans les conditions normales de température et de pression.
La masse de 1 L d'eau à la température de 4°C était la première définition du kilogramme. Par approximation, on prend pour masse volumique de l’eau dans les conditions normales la valeur de 1 000 kg/m3, une tonne par mètre cube soit un kilogramme par litre.
La chaleur massique de l’eau est de 4 186 J/(kg·K) dans les conditions normales de température et de pression. L’eau était utilisée comme étalon de chaleur dans d’anciens systèmes d'unité : la calorie (et la frigorie) quantifiait la chaleur à apporter (resp. soustraire) pour augmenter (resp. réduire) d'un degré Celsius la température d’un gramme d’eau : soit 4,185 joules.
Les chimistes se réfèrent parfois en blaguant à l'eau avec un nom savant (et justifié) comme du monoxyde de dihydrogène dans des parodies de recherche scientifique sérieuse qui présentent ce produit comme mortellement dangereux et à bannir.
| Temp. (°C) | Masse volumique (g/cm3) | Chaleur massique (J/g·K) | Viscosité (µPa·s) |
|---|---|---|---|
| 0 | 0,99984 | 4,2176 | 1793 |
| 10 | 0,99970 | 4,1921 | 1307 |
| 20 | 0,99821 | 4,1818 | 1002 |
| 30 | 0,99565 | 4,1784 | 797,7 |
| 40 | 0,99222 | 4,1785 | 653,2 |
| 50 | 0,98803 | 4,1806 | 547,0 |
| 60 | 0,98320 | 4,1843 | 466,5 |
| 70 | 0,97778 | 4,1895 | 404,0 |
| 80 | 0,97182 | 4,1963 | 354,4 |
| 90 | 0,96535 | 4,2050 | 314,5 |
| 100 | 0,95840 | 4,2159 | 281,8 |
| Altitude (m) | Temp. (°C) |
|---|---|
| 0 | 100 |
| 4 807 (Mont Blanc) | 85 |
| 8 844 (Everest) | 72 |
Propriétés de l'eau liées à la vie terrestre
Certaines des caractéristiques de l'eau font d'elle une molécule remarquable, aux particularités qui ont permis à la vie sur Terre de se développer. Ces caractéristiques, surtout liées à sa nature dipolaire, sont explicitées dans les chapitres qui suivent.
- L'eau a une force de cohésion élevée, ce qui rend cette matière difficile à évaporer (température d'ébullition particulièrement élevée pour une molécule de cette masse molaire). Cela permet à une importante phase liquide d'exister aux températures connues sur Terre, phase liquide indispensable à la vie telle que nous la connaissons.
- De même, ses propriétés de solvant " doux " permettent à un très grand nombre de réactions biochimiques de se produire.
- Le fait que la densité de l'eau soit plus grande à l'état liquide que solide, propriété commune avec le Bismuth, a une conséquence remarquable : la glace flotte. De surcroît, le fait que la densité de l'eau douce soit maximale à 4°C fait que la température au fond d'un lac ne peut pas descendre en dessous de 4°C (sauf cas extrêmes). Cela permet à la vie aquatique de survivre aux périodes glacées, car l'eau reste liquide sous son manteau de glace isolant (d'ordinaire la densité à l'état liquide est plus faible qu'à l'état solide pour les autres corps).
- Par ailleurs, sa tension superficielle particulièrement élevée permet le phénomène de capillarité, qui permet, entre autres, aux plantes de pousser et à de nombreux êtres vivants de se déplacer sur la surface de l'eau.
Indice de réfraction de l'eau
L'indice de réfraction n d'un milieu transparent est une mesure de sa capacité de changer la direction de propagation d'un rayon de lumière qui y entre. Si la lumière devait voyager dans l'espace vide puis pénétrer dans l'eau, on pourrait faire le rapport des sinus des angles d'incidence et de réfraction (mesurés à partir de la perpendiculaire à la surface de l'eau) selon la loi de Snell-Descartes (voir Réfraction) pour calculer l'indice de réfraction de l'eau relativement au vide. Cet indice ne dépendrait que de l'état physique de l'eau (solide, liquide ou gazeux).
Mais, dans la pratique, il est plus simple d'utiliser une interface ou dioptre air-eau pour obtenir l'indice de réfraction de l'eau par rapport à l'air, et puis pour le convertir de l'air au vide en multipliant par l'indice de l'air par rapport au vide. Le résultat, qui est toujours plus grand que 1, est le rapport de la vitesse de la lumière dans le vide à sa vitesse dans l'eau : la lumière voyage plus lentement dans l'eau que dans le vide (ou dans l'air).
Tous les milieux transparents sont dispersifs, ce qui signifie que la vitesse de la lumière change avec sa longueur d'onde λ. Plus précisément, dans la partie visible du spectre électromagnétique (approximativement 400 à 700 nanomètres) l'indice de réfraction est généralement une fonction décroissante de longueur d'onde : la lumière violette est plus déviée que le rouge. En outre, le taux de changement de l'indice de réfraction augmente également tandis que la longueur d'onde diminue. L'indice de réfraction augmente habituellement avec la densité du milieu.
L'eau présente toutes ces caractéristiques. Le tableau 1 montre les résultats de quelques mesures (Tilton et Tailor) de l'indice de réfraction de l'eau, n(λ) par rapport à de l'air sec de même température T que l'eau et à la pression de une atmosphère (760 mmHg ou 1 013 hPa).
| Longueur d'onde λ (Angströms) |
T = 10°C | T = 20°C | T = 30°C |
|---|---|---|---|
| 7 065 | 1,330 7 | 1,330 0 | 1,329 0 |
| 5 893 | 1,333 7 | 1,333 0 | 1,331 9 |
| 5 016 | 1,337 1 | 1,336 4 | 1,335 3 |
| 4 047 | 1,343 5 | 1,342 7 | 1,341 7 |
Pour convertir les valeurs sous forme de tableaux relatifs à l'indice du vide, ajoutez 4 à la quatrième position décimale. Notez que le n(λ) augmente pendant que la température de l'eau diminue. Ces résultats sont conformes aux attentes, puisque la densité de l'eau augmente lorsqu'elle se refroidit. Il est intéressant, cependant, que si les mesures sont faites à de plus basses températures l'indice ne montre pas d'extremum à 4°C, malgré le fait que la densité de l'eau soit maximale à cette température.
L’eau de mer contient des impuretés dissoutes, principalement sous forme de sels dissociés de sodium, de magnésium, de calcium, et de potassium. Sa densité, et par conséquent n(λ), dépendent donc de sa salinité exprimée en grammes de sels dissous par litre d'eau de mer (g/L) ou en grammes par kilogramme (g/kg) équivalent à des parties par mille en masse. Il est à noter que les fonds marins (< 3 000 m) sont à une température inférieures à 4°C (environ 2°C ou moins) car l'eau salée voit son maximum de densité à une température inférieure, et surtout cet extremum s'estompe en un plateau constant avant la congélation. Le mouvement des masses océaniques profondes est dominé par la variation de leur salinité. Elles proviennent principalement de la saumure issue de la formation de la banquise (congélation de l'eau de mer) en hiver aux pôles, ainsi que du refroidissement des eaux de surfaces dans les mêmes conditions.
Le tableau 2 (pris de Dorsey) montre comment le n(λ) augmente avec la salinité pour les D-lignes de sodium (moyenne : 5 893 angstroms = 589,3 nm) à 18°C.
| salinité (g/kg) |
valeur de n(λ) |
Emplacement |
|---|---|---|
| 5 | 0,000 97 | mers baltiques nordiques |
| 10 | 0,001 94 | |
| 15 | 0,002 90 | |
| 20 | 0,003 86 | enfoncements de Biafra |
| 25 | 0,004 82 | |
| 30 | 0,005 77 | |
| 35 | 0,006 73 | surface de l'Océan Atlantique |
| 40 | 0,007 69 | mers rouges nordiques |
L'indice de réfraction est également une fonction de la pression de l'eau, mais la dépendance est tout à fait faible en raison de l'incompressibilité relative de l'eau (comme tous les liquides). En fait, sur les gammes normales des températures (0 - 30°C), l'augmentation approximative du n(λ) est 0,000 016 quand la pression de l'eau augmente d'une atmosphère.
Clairement, les facteurs les plus significatifs affectant le n(λ) sont la longueur d'onde de la lumière et la salinité de l'eau. Néanmoins, le n(λ) excède de moins de 1 % la gamme indiquée des valeurs de ces variables.
- Références
- L. W. Tilton et J. K. Taylor, stand national de bureau de recherche de J., 20, 419 (RP1085) 1938.
- E. Dorsey, " propriétés d'Eau-Substance ordinaire ", (Reinhold Publishing Corporation 1940).
Chimie
Nature dipolaire de l'eau
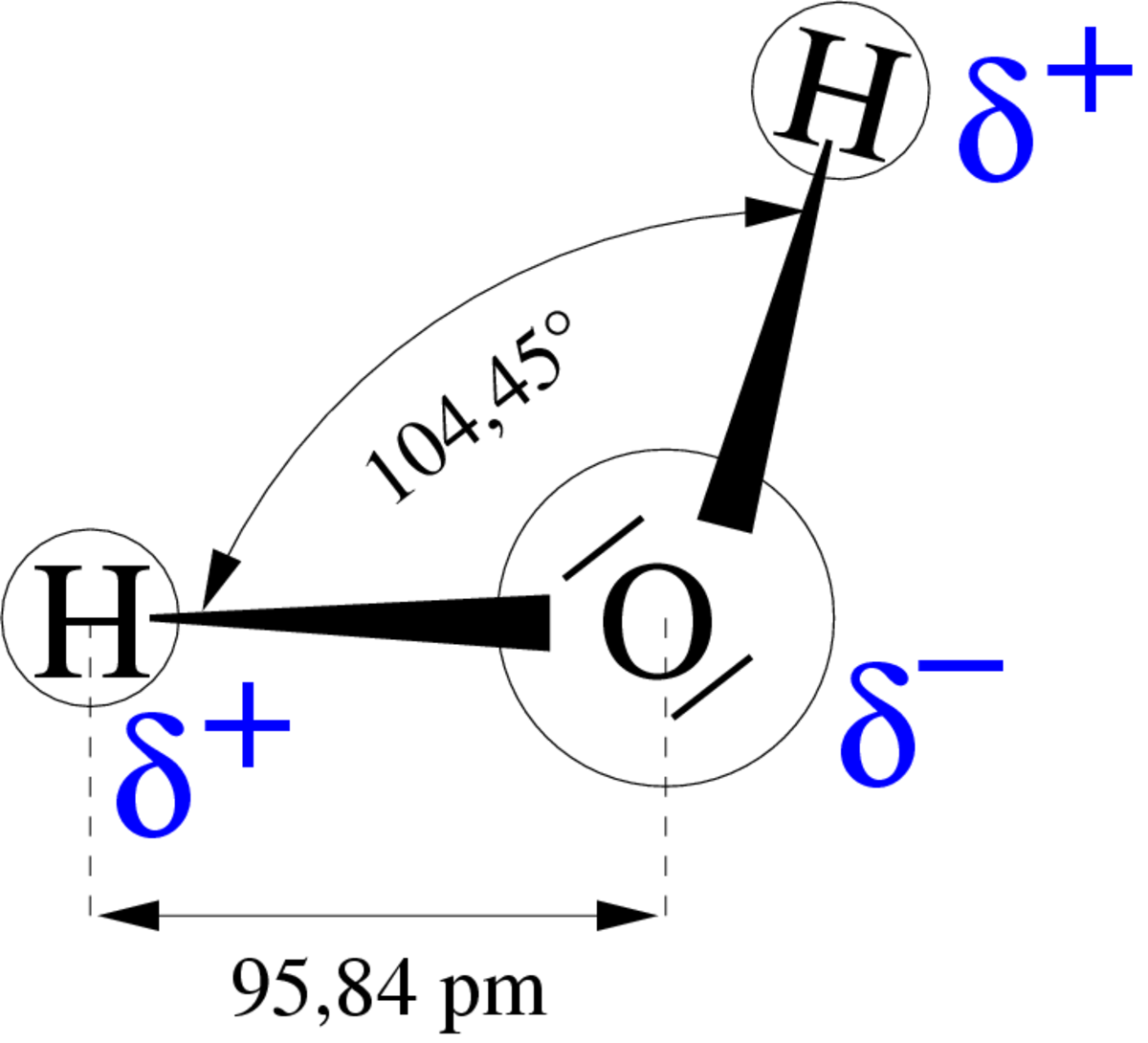
Une propriété très importante de l'eau est sa nature polaire. La molécule d'eau forme un angle de 104,45° au niveau de l’atome d'oxygène entre les deux atomes d'hydrogène. Puisque l'oxygène a une électronégativité plus forte que l'hydrogène, le côté de la molécule d'eau où se trouve l'atome d'oxygène est chargé négativement, par comparaison avec le côté hydrogène. Une molécule avec une telle différence de charge est appelée un dipôle (molécule polaire), ayant un moment dipolaire de 1,83D. Cette différence de charge fait que les molécules d'eau s'attirent les unes les autres, le côté positif de l'une attirant le côté négatif d'une autre. Un tel lien électrique entre deux molécules s'appelle un pont hydrogène ou liaison hydrogène.
Cette polarisation permet aussi à la molécule d'eau de dissoudre les corps ioniques, en particulier les sels, et de les maintenir dans cet état en entourant chaque ion d'une coque de molécules d'eau, c'est la solvatation (voir ci-dessous l'eau comme solvant).
Cette force d'attraction, relativement faible par rapport aux liaisons chimiques covalentes de la molécule elle-même, est à la source de propriétés comme un point d'ébullition élevé (quantité d'énergie calorifique nécessaire pour briser les ponts hydrogènes), ainsi qu'une capacité calorifique élevée.
À cause des ponts hydrogènes également, la densité de l'eau liquide est supérieure à la densité de la glace (état où l’eau est cristallisée). De ce fait, en hiver la glace qui se forme à la surface d'un étang y reste et protège du gel l'eau située plus bas, ce qui permet aux poissons et autres êtres vivants d'y survivre. L'eau atteint sa plus haute densité à la température de 4°C, qui est ainsi la température qu'on trouve typiquement au fond d'un étang gelé. Une autre conséquence est que la glace fond quand suffisamment de pression lui est appliquée.
Équilibre acidobasique
L'eau se dissocie naturellement en ion hydronium H3O+ et ion hydroxyde OH− :
- 2H2O = H3O+ + OH−.
Par perte d'un proton H+, elle devient OH−. Par gain d'un proton H+, elle devient l'ion hydronium H3O+. On dit donc que c'est une espèce amphotère. Du fait de l'équilibre, à une température donnée, le produit des concentrations de ces ions, ou " produit de dissociation ", est constant. À 25°C, il vaut :
- [H3O+]·[OH−] = 10−14 (pas d'unité car constante d'équilibre).
La concentration (en mole par litre) étant symbolisée par une mise entre crochets.
Les ions hydronium et hydroxyde sont très réactifs, ils peuvent attaquer d'autres matériaux, les dissoudre. On définit l'acidité grâce à la concentration en ion hydronium, par le pH :
- pH = −log10 [H3O+].
À 25°C, le pH de l'eau pure vaut 7, il est dit neutre. L’ajout de certains produits dits " acides " va déplacer l’équilibre de dissociation de l’eau et abaisser le pH (augmentation du nombre d'ions hydronium) ; à l'inverse, l'ajout de certains produits dits " basiques " va déséquilibrer la réaction dans l'autre sens, favoriser la présence d'ions hydroxyde et augmenter le pH.
On note que l'eau peut capturer un proton ou en libérer un, c'est donc un ampholyte, c'est-à-dire à la fois un acide et une base. Cet équilibre acide/base est d'une importance capitale en chimie minérale comme en chimie organique.
L'eau comme solvant
Grâce à sa polarité, l’eau est un excellent solvant. Quand un composé ionique ou polaire pénètre dans l’eau, il est entouré de molécules d'eau. La relative petite taille de ces molécules d’eau fait que plusieurs d'entre elles entourent la molécule de soluté. Les dipôles négatifs de l'eau attirent les régions positivement chargées du soluté, et vice versa pour les dipôles positifs. L'eau fait un excellent écran aux interactions électriques (la permittivité électrique εe de l'eau est de 78,5 à 25°C), il dissocie donc facilement les ions.
En général, les substances ioniques et polaires comme les acides, alcools, et sels se dissolvent facilement dans l'eau, et les substances non-polaires comme les huiles et les graisses se dissolvent difficilement. Ces substances non-polaires restent ensemble dans l’eau car il est énergétiquement plus facile pour les molécules d'eau de former des ponts hydrogène entre elles que de s'engager dans des interactions de van der Waals avec les molécules non polaires.
Un exemple de soluté ionique est le sel de cuisine alias chlorure de sodium, NaCl, qui se sépare en cations Na+ et anions Cl−, chacun entouré de molécules d'eau. Les ions sont alors facilement transportés loin de leur matrice cristalline. Un exemple de soluté non ionique est le sucre de table. Les dipôles des molécules d'eau forment des ponts hydrogène avec les régions dipolaire de la molécule de sucre, et celle-ci est ainsi extraite vers l'eau liquide.
Cette faculté de solvant de l'eau est vitale en biologie, parce que certaines réactions biochimiques n'ont lieu qu'en solution (par exemple, réactions dans le cytoplasme ou le sang.) C'est pourquoi, pour le moment, l’eau liquide est considérée comme indispensable à la vie et est activement recherchée sur les divers astres du système solaire, notamment sur Mars et Europe une lune de Jupiter.
Tension superficielle
Les ponts hydrogène confèrent à l’eau une grande tension superficielle et une grande cohésion. Cela se voit quand de petites quantités d'eau sont posées sur une surface non soluble et que l'eau reste ensemble sous forme de gouttes. Cette propriété qui se manifeste par la capillarité est utile dans le transport vertical de l'eau chez les végétaux et nuisible avec la remontée d'humidité dans les murs de maisons.
Conductivité
L'eau pure est en réalité un isolant, qui conduit mal l'électricité. Mais puisque l'eau est un si bon solvant, elle contient souvent une bonne quantité de soluté dissous, le plus souvent des sels. Si l'eau contient de telles impuretés, elle peut conduire l'électricité facilement. Le stator des très gros alternateurs est refroidi par circulation d'eau déionisée dans les conducteurs creux de l'enroulement. Malgré les différences de potentiel de plusieurs dizaines de milliers de volts entre le circuit de refroidissement et les conducteurs électriques, il n’y a pas de problèmes de fuite de courant. Voir conductivité électrique (mesure).
Décomposition de l'eau (thermolyse et électrolyse)
La première décomposition de l’eau fut faite par Lavoisier, en faisant passer de la vapeur d'eau sur du fer chauffé au rouge (thermolyse). Ce faisant, il établit que l’eau n’était pas un élément mais un corps chimique composé de plusieurs éléments.
La thermolyse de l’eau commence à devenir significative vers 750°C, et elle est totale vers 3 000°C. La réaction produit du dioxygène et du dihydrogène :
- 2H2O ↔ 2H2 + O2.
L’autre manière de décomposer l'eau est l'électrolyse. Sous l'effet d'un courant qui la traverse, l'eau peut être divisée en dihydrogène et dioxygène. Les molécules d'eau se dissocient naturellement en ions H3O+ et OH−, qui sont attirés par la cathode et l'anode respectivement mais comme cette dissociation est faible dans la pratique on a recours à des catalyseurs comme l’acide sulfurique ou l’hydroxyde de sodium. À l’anode, quatre ions OH− se combinent pour former des molécules de dioxygène O2, deux molécules d'eau, et libérer quatre électrons. Les molécules de dioxygène ainsi produites s'échappent sous forme de bulles de gaz vers la surface, où elles peuvent être collectées. Dans le même temps, à la cathode, il y a une libération de deux molécules de dihydrogène H2 avec utilisation de quatre électrons.
- 4OH− → O2 + 2H2O + 4e−.
- 4H3O+ + 4e− → 2H2 + 4H2O.
Utilisation de l'eau
L'eau dans l'alimentation
- Eau potable
- Eau du robinet
- Eau de table
- Eau de source
- Eau minérale
- Eau gazeuse
- Eau plate
Lutte contre l'incendie
- en tant qu'agent d'extinction
Symbolique, usage et mythologie
- L'eau, élément vital pour l'homme, est la boisson naturelle par excellence.
- L'eau est un des quatre éléments classiques mythiques avec le feu, la terre et l'air, et était vue par certains comme l'élément de base de l'univers. Les caractéristiques de l'eau dans ce système sont le froid et l'humidité.
- Dans la symbolique occidentale, l’eau symbolise la purification, le renouveau : par exemple, l'eau bénite du baptême, l'eau coulante d'un fleuve.
- C'est aussi l'un des cinq éléments chinois avec la terre, le feu, le bois et le métal, associé au Nord et à la couleur noire, et l'un des cinq éléments japonais.
- Dans la théorie des humeurs corporelles, l'eau était associée au flegme, aussi dénommée pituite en physiologie antique.
L’eau artistique
L'eau fascine depuis toujours les artistes. Elle a souvent été utilisé par l’Aquatique Show International, qui joue avec l'eau et qui est passé maître dans l'art d'accorder les lumières, la musique et les eaux en mouvement. Elle est aussi un élément indispensable pour certain sport où elle est l'élément principal comme pour la natation synchronisée où la nageuse joue avec l'eau pour lui faire faire des mouvements harmonieux. L’eau est également bien présente sur les scènes de théâtre, d'opéra, de ballet, dans le music-hall, dans les cirques, ainsi que les concerts qui cherche à reproduire les sons de l'eau car ils sont plus nombreux qu'on ne le pense. Malgré tous les défis que l'eau demande, beaucoup ont relevé ce défi pour la beauté d'un élément qui provoque tant de rêves mais également de nombreux cauchemar pour le monde.
L'eau dans les croyances
L’eau a longtemps revêtu plusieurs aspects dans les croyances et les religions des peuples. Ainsi, de la mythologie gréco-romaine aux religions actuelles, l’eau est toujours présente sous différents aspects : destructrice, purificatrice, source de vie, guérisseuse et protectrice.
- L'eau destructrice:
L’eau revêt cet aspect-là notamment lorsqu’on parle de fin du monde ou de genèse. Mais cela ne se limite pas aux religions monothéistes. Ainsi, dans l’épopée de Gilgamesh, une tempête qui dura six jours et sept nuits était à l’origine des inondations et de la destruction de l’humanité. Les Aztèques ont eux aussi cet aspect de l’eau puisque le monde du Soleil d’Eau placé sous le signe de l’épouse de Tlaloc est détruit par déluge qui rasera même jusqu’aux montagnes. " Et l’Éternel dit: J’exterminerai de la face de la terre l’homme que j’ai créé, depuis l’homme jusqu’au bétail, aux reptiles, et aux oiseaux du ciel; car je me repens de les avoir faits. ", c’est par cela qu’est désignée la fin du monde dans la genèse judéo-chrétienne, et d’ajouter : " Les eaux grossirent de plus en plus, et toutes les hautes montagnes qui sont sous le ciel entier furent couvertes. "(La genèse, (VI, 7)/ (VII, 19)). Le mythe des aborigènes d’Australie est, quant à lui, attaché à l’idée de punition et non pas de destruction, puisqu’une grenouille géante aurait absorbé toute l’eau et asséché la terre mais aurait tout recraché en rigolant aux contorsions d’une anguille.
- L’eau purificatrice :
Cet aspect donne à l’eau un caractère presque sacré dans certaines croyances. En effet, outre la purification extérieure que confère l’eau, il y a aussi cette faculté d’effacer les difficultés et les péchés des croyants à son contact, et de laver le croyant de toute souillure. Les exemples sont nombreux allant de la purification dans le Gange dans l’hindouisme (où beaucoup de rituels sont exécutés au bord de l’eau tels que les funérailles), ou les ablutions à l’eau dans l’Islam jusqu’au baptême dans le christianisme ou l’initiation des prêtres shintoïstes.
- L’eau guérisseuse et protectrice :
Outre l’aspect purificateur, l’eau s’est étoffée au cours des siècles et des croyances d’une faculté de guérison. Plusieurs signes de culte et d’adoration datant du néolithique ont été retrouvés près de sources d’eau en Europe. Longtemps, des amulettes d’eau bénite ont été accrochées à l’entrée des maisons pour protéger ses occupants du Mal. On considère que le contact avec certaines eau peut aller jusqu’à guérir de certaines maladies. L’exemple le plus proche est celui du pèlerinage à Lourdes en France où chaque année des milliers de gens se rendent pour se baigner dans sa source chaude. Parmi les cas de guérison par l’eau de Lourdes, 67 ont été reconnus par l’église catholique. Du point de vue de la science, les propriétés curatives ont été démontrées puisque, aujourd’hui, l’hydrothérapie est courante dans les soins de certaines maladies.
- L’eau source de vie :
Bien que les sciences aient démontrées que l’eau était indispensable à la vie, la mythologie avait bien avant établi le rapport entre l’eau et la naissance. Ainsi, plusieurs dieux et déesses romains et grecques sont issus des eaux : ainsi Océan, un Titan, le fleuve qui entoure le monde et son épouse Téthys, une titanide tous deux issus de l’eau donnèrent naissance aux dieux fleuves et à plus de trois milles Océanides, leurs filles. D’autres plus célèbres ont leur vie liée à l’eau tels Vénus (" celle qui sort de la mer "), Amphitrite (déesse de la mer), Poséidon ou Nérée (divinité marine).