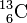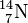Isobare (chimie) - Définition
Pour chaque élément chimique, on a :
- Z = nombre de protons (ou d'électrons), également appelé numéro atomique
- N = nombre de neutrons
- A = nombre de nucléons (protons + neutrons), voir aussi masse atomique
On note ZX le nombre Z de protons de l'élément nommé X, ainsi que AX le nombre total A de nucléons dans l'élément X.
Deux éléments qui possèdent le même nombre de nucléons sont des isobares (Z différents, A identiques), par exemple le Carbone 14 et l'Azote 14 (notation:
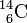
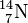
On appelle isotopes deux variétés d'un même élément qui se différencient par leur nombre de neutrons (numéros Z identiques, mais masses atomiques A différentes), par exemple le Carbone 12 et le Carbone 14 (notation:
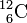
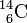
Des éléments qui ont le même nombre de neutrons sont dits isotones (Z différents, A différents, N identiques), par exemple le Carbone 13 et l'Azote 14 (notation: