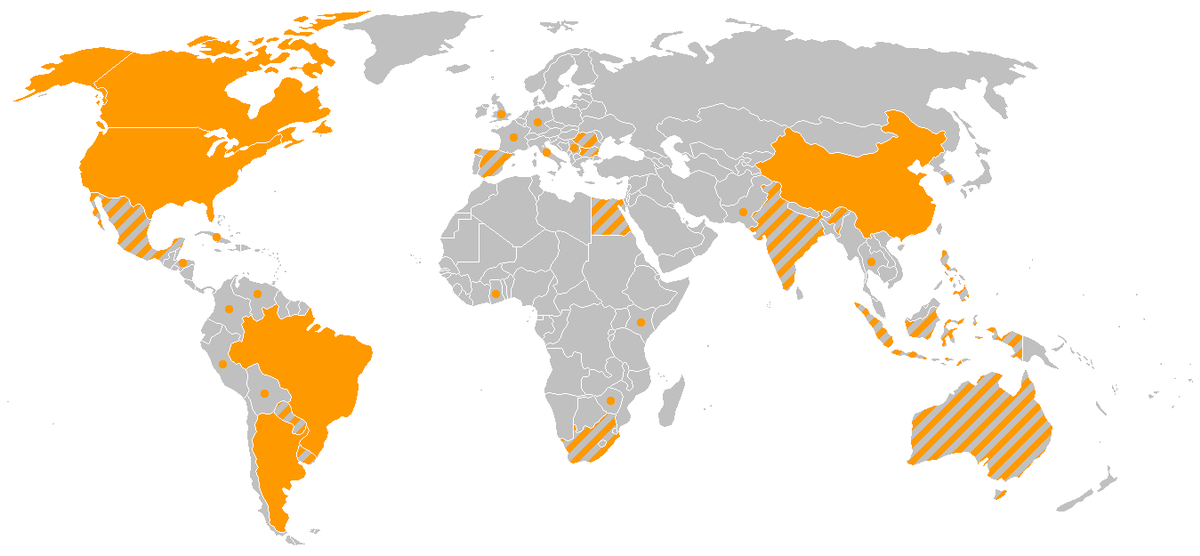
Organisme génétiquement modifié - Définition
Un organisme génétiquement modifié ou OGM est " un organisme vivant dont le patrimoine génétique a été modifié par génie génétique, soit pour accentuer certaines de ses caractéristiques ou lui en donner de nouvelles considérées comme désirables, soit au contraire pour atténuer, voire éliminer certaines caractéristiques considérées comme indésirables "[1] selon la Commission de l’éthique de la science et de la technologie du Québec.
Définition juridique
Au sein de l'Union européenne, la directive 2001/18/CE définit un OGM comme suit :
" Un organisme génétiquement modifié est un organisme (à l'exception des êtres humains) dont le matériel génétique a été modifié d'une manière qui ne peut s'effectuer naturellement par multiplication et/ou par recombinaison. "[2]
La directive 2001/18/CE indique que les techniques de modification génétique visées dans cette définition sont, entre autres :
" 1) les techniques de recombinaison de l'acide désoxyribonucléique impliquant la formation de nouvelles combinaisons de matériel génétique par l'insertion de molécules d'acide nucléique, produit de n'importe quelle façon hors d'un organisme, à l'intérieur de tout virus, plasmide bactérien ou autre système vecteur et leur incorporation dans un organisme hôte à l'intérieur duquel elles n'apparaissent pas de façon naturelle, mais où elles peuvent se multiplier de façon continue;
2) les techniques impliquant l'incorporation directe dans un organisme de matériel héréditaire préparé à l'extérieur de l'organisme, y compris la micro-injection, la macro-injection et le microencapsulation;
3) les techniques de fusion cellulaire (y compris la fusion de protoplastes) ou d'hybridation dans lesquelles des cellules vivantes présentant de nouvelles combinaisons de matériel génétique héréditaire sont constituées par la fusion de deux cellules ou davantage au moyen de méthodes qui ne sont pas mises en œuvre de façon naturelle. "
En revanche, cette même directive précise que :
- ne sont pas des OGM : les organismes produits par mutagenèse, ou par la fusion cellulaire (y compris la fusion de protoplasmes) de cellules végétales d'organismes qui peuvent échanger du matériel génétique par des méthodes de sélection traditionnelles.
- ne sont pas considérés comme entraînant une modification génétique (sauf emploi d'acide nucléique recombinant ou d'OGM déjà obtenu) : la fécondation in vitro, les processus naturels tels que la conjugaison, la transduction, la transformation, ou l'induction polyploïde..
Échange de gènes dans la nature
La dénomination d'organisme génétiquement modifié fait référence à une modification artificielle du patrimoine génétique d'un organisme. Mais des systèmes de transfert naturel d'ADN existent, et ils conduisent à l'apparition d'organismes dont le matériel génétique est transformé. Les principaux dispositifs d'échanges naturels de gènes, dont certains sont exploités par les techniques du génie génétique, sont les suivants :
- Les rétrovirus sont des virus capables de faire intégrer leur information génétique dans le génome de leur hôte. Grâce à des séquences présentes de part et d’autre de l’ADN viral, qui sont reconnues par le génome hôte, ce dernier accepte sa césure et l’intégration de l'ADN viral.
- Le plasmide, qui est une petite molécule circulaire d’ADN, est mobile et peut passer d’une cellule à une autre. Certains plasmides peuvent alors s’intégrer au génome de la cellule hôte. Cette forme de transfert d'ADN est observée pour les bactéries, notamment pour des gènes de résistance aux antibiotiques. L’intégration de plasmide bactérien au génome d'un organisme supérieur est limité à des bactéries spécifiques, et pour des couples d'espèces déterminés. Ainsi, Agrobacterium tumefaciens est une bactérie dont le plasmide est capable d’entrer dans une cellule végétale et de s’intégrer à son génome.
- La reproduction avec des individus interféconds permet l'échange d'ADN, entre deux individus de deux variétés, sous-espèces (croisement intraspécifique), espèces (croisement interspécifique) ou genres (croisement intergénérique) différents. L'hybride ainsi produit présente un mélange des caractéristiques génétiques des deux parents.
- Les mutations, par changement d'un nucléotide par un autre, insertion ou délétion de séquences de nucléotides, peuvent induire l'apparition de maladies génétiques ou de cancers. Mais les mutations constituent aussi l'un des moteurs de l'évolution des espèces.
- Dans le cadre de l'endosymbiose, un ensemble de processus évolutifs ont conduit à la formation d'organites (mitochondrie et chloroplaste) dans les cellules eucaryotes, à la suite de l'intégration de bactéries et de cyanobactéries. La majorité du génome de l'endosymbiote a été transféré dans le noyau de l'hôte.
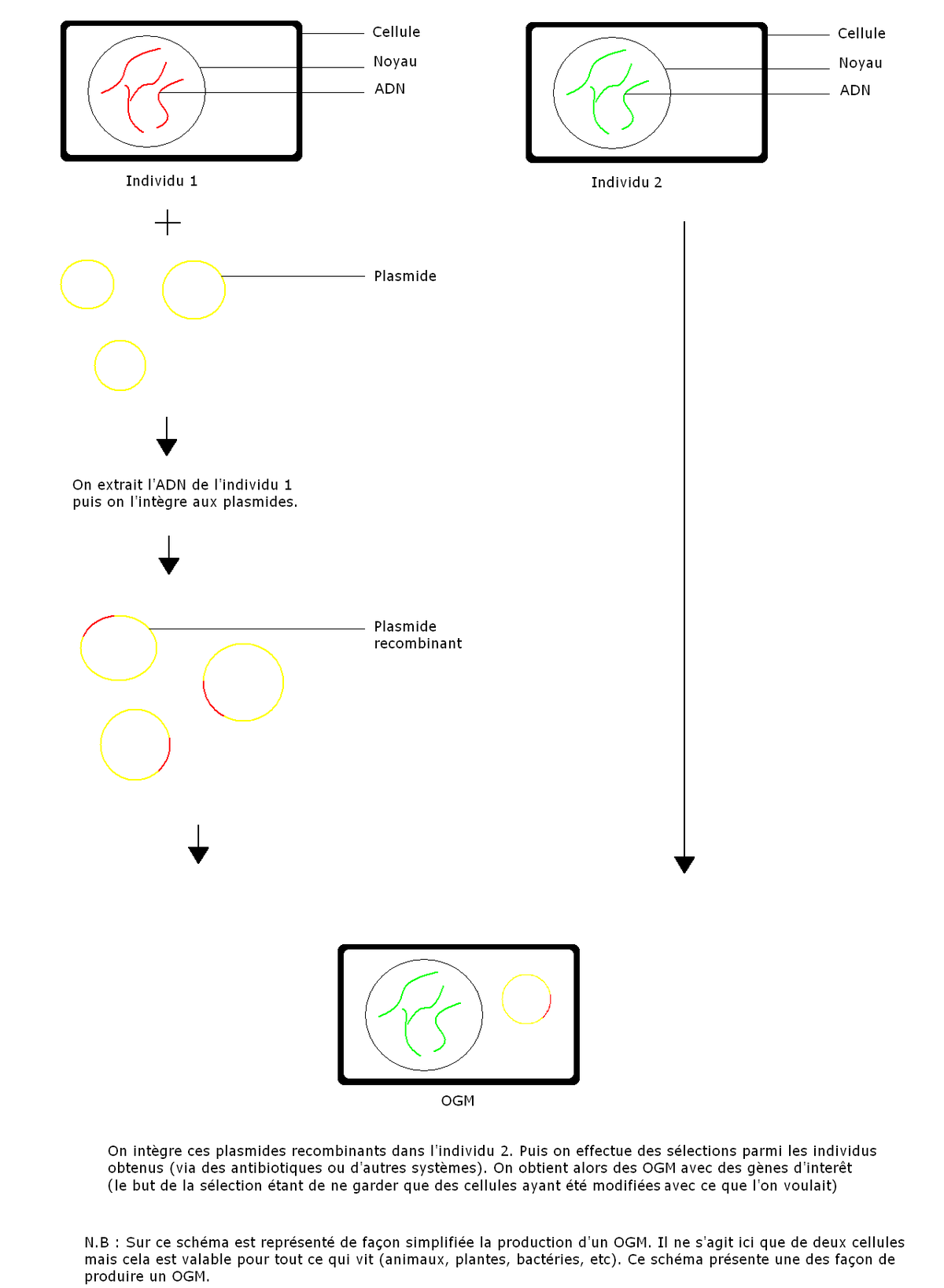
Processus de création des OGM et gènes concernés
Techniques de modification génétique
Transformation de bactéries
- Transformation sans intégration dans l'ADN chromosomique
Les plasmides des bactéries présentent l'intérêt d'être faciles à purifier et à modifier pour y intégrer de nouveaux gènes. Le plasmide transformé est incorporé dans les bactéries où il reste distinct de l'ADN chromosomique (sauf dans le cas des épisomes), tout en étant capable d'exprimer le gène d'intérêt. Le plasmide modifié comporte généralement un gène de résistance à un antibiotique, qui est employé comme marqueur. Ainsi, seules les bactéries ayant incorporé le plasmide sont capables de croître dans un milieu comportant un antibiotique, ce qui permet de les sélectionner.
Grâce aux capacités importantes de multiplication des bactéries (Escherichia coli double sa population toutes les 20 minutes), il est possible par cette technique de disposer de la séquence génétique d'intérêt en grande quantité.
En revanche, la spécificité des systèmes plasmidiques limite les bactéries capables d'incorporer le plasmide modifié. De plus, l'instabilité de la transformation est aggravée par le fait que l'ADN chromosomique n'est pas modifié, et que le plasmide peut lui-même être relativement instable.
- Transformation avec intégration dans l'ADN chromosomique
Les épisomes sont des plasmides possédant certains gènes supplémentaires codant la synthèse d'enzymes de restriction qui permettent son intégration aux chromosomes bactériens par une recombinaison épisomale.
Une fois intégré au chromosome de la cellule, la transmission du ou des caractères génétiques est assurée lors de la mitose de cellules mères en cellules filles, contrairement aux plasmides qui se répartissent de façon aléatoire.
Un autre moyen de procéder à une transformation de bactéries avec intégration d'ADN, est d'utiliser des transposons. Chez certaines bactéries, ces transposons actifs peuvent véhiculer et faire intégrer le gène d'intérêt.
Transformation de plantes et d'animaux
- Transfert indirect d'ADN ou transfert par vecteur
De l'acide désoxyribonucléique (ADN), étranger à l'organisme, est introduit dans l'organisme de l'hôte par l'intermédiaire d'un virus, d'un plasmide bactérien ou tout autre système vecteur biologique. Le vecteur et l'hôte doivent pouvoir se reconnaître mutuellement, d'où la spécificité des systèmes employés. Par le phénomène de recombinaison génétique, l'ADN introduit peut être intégré dans le génome et entraîner la formation d'une nouvelle combinaison du matériel génétique. Cette nouvelle information doit pouvoir se maintenir dans le génome sur les générations suivantes.
Les principales techniques employées sont les suivantes :
- Agrobacterium tumefaciens : cette bactérie possède un plasmide capable de s'intégrer dans le génome des plantes, ce qui en fait le vecteur le plus largement employé pour la création de végétaux transgéniques. Le transgène est intégré dans le plasmide de cette bactérie, qui le véhicule jusqu'à l'ADN chromosomique de l'hôte. Le gène d'intérêt ne se trouve pas dans toutes les cellules, et il a une expression variable. Pour ces deux raisons, une phase de tri est nécessaire.
- Rétrovirus : ces virus ayant la capacité d'intégrer leur matériel génétique dans les cellules hôtes pour développer l'infection, des vecteurs ont été élaborés en remplaçant les gènes permettant l'infection par un transgène. Toutefois, les rétrovirus sont très spécifiques à leur hôte, et ces vecteurs ne peuvent accepter de transgène de taille trop grande.
- Transposons : cette séquence d'ADN transposable est utilisée avec un transgène auquel ont été ajoutés à ses extrémités des sites de reconnaissance de l'ADN. La taille du transgène doit être limitée. Les techniques à base de transposons sont employées essentiellement sur la drosophile.
- Transfert direct d'ADN
Des organismes dont les membranes sont fragilisées ou des cellules végétales dépourvues de parois (telles les protoplastes) sont mis en contact avec de l'ADN. Puis un traitement physique ou chimique permet l'introduction de l'ADN dans les cellules. D'autres techniques telles que la micro-injection, la macro-injection et d'autres techniques de biolistique se basent sur l'introduction mécanique de l'ADN dans les cellules.
- Fusion cellulaire
La fusion cellulaire (y compris la fusion de protoplastes) ou d'hybridation dans lesquelles des cellules vivantes présentant de nouvelles combinaisons de matériel génétique héréditaire sont constituées par la fusion de deux cellules ou davantage au moyen de méthodes qui ne sont pas mises en œuvre de façon naturelle.
Gènes concernés
On définit six catégories de gènes concernés.
Gènes de résistances aux insectes
Cette résistance est conférée aux plantes par des gènes codant une forme tronquée d'endotoxines protéiques, fabriquées par certaines souches de Bacillus thuringiensis (bactéries vivant dans le sol). Il existe de multiples toxines, actives sur différents types d'insectes : par exemple, certaines plantes résistantes aux lépidoptères, tels que la pyrale du maïs (Ostrinia nubilalis), portent des gènes de type Cry1(A).
Gènes de tolérance aux herbicides
Il s'agit par exemple de gènes conférant une tolérance au glufosinate d'ammonium (que l'on peut trouver dans l'herbicide Basta) et au glyphosate (dans le Roundup).
Les OGM possédant ces gènes sont vendus par les semenciers comme plus respectueux de l'environnement car nécessitant moins d'herbicides, mais il est à noter que certaines plantes sauvages (au moins 28 recensées) résistent à ces herbicides, et qu'il faut donc à court terme augmenter les doses d'herbicides, comme démontré dans certains cas en Argentine [3], ces gènes de tolérances peuvent, dans ces situations, avoir alors un interêt limité.
Gènes marqueurs
Les gènes de résistance aux antibiotiques sont utilisés comme marqueurs de sélection, pour repérer les cellules dans lequel le gène voulu a été introduit. Les trois principaux marqueurs utilisés étaient des gènes provoquant une résistance vis-à-vis des familles d'antibiotiques suivantes : kanamycine/néomycine, ampicilline et streptomycine. Dans tous les cas, les antibiotiques spécifiques de chacune de ces familles sont peu, voire pas utilisés en médecine humaine. Aujourd'hui, on emploie de plus en plus une méthode d'excision de ces "cassettes de résistance", pour ne plus laisser en place que le gène d'intérêt, de manière à être sûr que ces gènes de résistance n'interfèrent pas avec le phénotype observé.
Gène de stérilité mâle
Le gène de stérilité mâle (barnase) code une ribonucléase, et est contrôlé de façon à ne s'exprimer que dans le grain de pollen. Il s'oppose alors à l'expression des molécules d'acide ribonucléique nécessaires à la fécondité. Le gène barstar, quant à lui est un inhibiteur de cette ribonucléase. Ces deux gènes ont été utilisés pour empêcher l'autofécondation et permettre la production de semences hybrides homogènes pour des salades en Europe.
Gènes antisens ou sens bloquant la traduction d'autres gènes
L'opération consiste à introduire un exemplaire supplémentaire d'un gène donné, mais en orientation inverse (on parle alors de gène " antisens "), ou, parfois, dans le même sens, mais tronqué. La présence de ce gène " erroné " diminue de manière drastique l'étape de traduction du gène normal, ce qui empêche la synthèse de l'enzyme codée par ce gène. Un exemple de ce type est celui de la pomme de terre, dont les synthétases sont synthétisées en quantités limitées, de façon à produire un amidon différent.
Gènes utilisés pour réaliser des animaux transgéniques
Exemples très nombreux : souris et mouches pour expériences scientifiques (gène de fluorescence ,souris knock out...), modèles de maladies génétiques. Production de médicament ,bioréacteur vivant. Animaux de loisir (GloFish,poisson rouge fluorescent).
Enjeux
Conséquences
Conséquences directes
Conséquences positives
Production de protéines humaines
On peut produire grâce aux OGM des protéines humaines nécessaires pour le traitement de certaines maladies. Par exemple, on a besoin de plus en plus de sang mais les donneurs se font de plus en plus rares. Une des principale utilisation du sang est la transfusion pendant les opérations pour compenser les pertes dues au traumatisme. Dans le corps humain, les gènes globine alpha du chromosome 11 et la globine bêta du chromosome 16 sont responsables de la synthèse de l'hémoglobine. On a donc eu l'idée de faire synthétiser de l'hémoglobine humaine par des végétaux, le tabac. Pour ce faire, on utilise la même méthode que précédemment. Mais ce procédé n'est pas au point car il ne produit que l'hémoglobine et non les globules rouges donc l'hémoglobine ne peut être utilisée directement. Autres exemples : l'insuline humaine ainsi que l'hormone de croissance sont produites via des bactéries génétiquement modifiées et utilisées maintenant largement dans le monde. Le fait de les obtenir de cette manière a supprimé le risque antérieur d'obtenir ces protéines éventuellement contaminées par des virus voire par le prion de la maladie de Kreutzsfeld-Jacob.
Thérapie génique
Les maladies génétiques sont causées par la présence d'un gène conduisant à la synthèse d'une protéine non fonctionnelle. Pour pallier ce problème on a imaginé d'insérer une version correcte du gène concerné dans les cellules de l'organisme du malade. Pour cela on utilise les mêmes techniques que pour produire un OGM. La grande différence est cependant qu'il s'agit ici de modifier un organisme entier avec un très grand nombre de cellules et non quelques cellules. Cette thérapie est donc beaucoup plus difficile à mettre au point que la technique de fabrication d'un OGM, et nécessitera encore de nombreuses années de recherche avant de pouvoir être mise en œuvre à grande échelle.
Conséquences potentielles négatives
Allergies
Une des conséquences négatives pourrait être l'apparition d'allergies chez le consommateur. On peut s'attarder sur le principe de l'allergie. Trois acteurs interviennent principalement lors du déclenchement de l'allergie : des anticorps IgE, des plasmocytes et des lymphocytes. Des médiateurs qui sont en fait des substances sécrétées lors d'une réaction allergique provoquent les troubles physiques allergiques : vasodilatation, activation des cellules sécrétrices de mucus, contraction des muscles lisses, etc…
il convient de distinguer deux cas: + soit le transgène code un allergène connu ou provient d'un organisme chez lequel des allergènes ont été identifié + soit on ne dispose d'aucune donnée clinique ou épidémiologique mentionnant une potentielle allergénicité pour l'organisme chez lequel on prend le gène. Le risque serait pourrait être alors d'introduire un gène codant une protéine ayant des propriétés allergèniques non encore identifiées. Sur un plan théorique, le risque pourrait aussi provenir de l'insertion aléatoire du gène dans le génome du végétal. Cette insertion pourrait interférer avec le fonctionnement d’autres gènes régulant des fonctions tout à fait différentes de celle concernées par la transgénèse. La modification involontaire du profil d’expression d’autres protéines pourrait résulter en une expression d'allergène naturel de la plante auparavant peu ou pas exprimé. Notons cependant que ces derniers risques existent également avec les organismes (plantes ou animaux) sélectionnés par les méthodes conventionnelles [4]. De plus et à ce jour, aucun OGM mis sur le marché n'a été responsable d'aucune allergie. En effet, différents tests préalables sont effectués sur la protéine codée par le transgène afin de vérifier qu'elle n'a pas les caractéristiques classiques des allergènes connus.
Transfert de la capacité de résistance à un antibiotique
Le deuxième risque est le risque de transfert de la capacité de résistance à un antibiotique utilisé comme marqueur à une bactérie de l’intestin. En 1977, le professeur Curtis publiait un premier rapport sur ce risque de transfert. Le scientifique procède en étudiant le risque pour chacun des modes de transfert de l’information génétique chez les bactéries. -pour la conjugaison : -transfert d’un plasmide conjuguant d’une bactérie à une autre lors d’un accouplement. Parfois les plasmides conjuguant entraînent avec eux d’autres plasmides : c’est la mobilisation. Les plasmides utilisés comme vecteurs pour les manipulations génétiques ne sont pas conjuguant. Pour passer d’une bactérie à une autre par conjugaison, un plasmide doit être mobilisé par un autre conjuguant. Or l'Escherichia coli n’en a pas. Il faut donc qu’elle reçoive d’une première conjugaison un plasmide conjuguant et que le plasmide manipulé soit mobilisé lors d’une deuxième conjugaison avec une bactérie intestinale. Le risque de transfert d’un plasmide conjuguant dans l’intestin est de 10-8. Le risque d’un transfert de plasmide non-conjuguant par mobilisation est de 10-4. Les risque total est de : 10-8 x10-4 x 10-8 = 10-20 par bactérie survivante et par jour. La probabilité de ce risque de transmission est d'ailleurs certainement inférieure encore à 10-20, car ces calculs ne prennent pas pris en compte d'autres aspects très importants : l'intégrité de la séquence qui va être transférée, (Il suffit, en effet, qu'elle soit ne serait-ce que partiellement hydrolysée préalablement à son insertion), son insertion en phase de lecture, que les signaux de régulation/transcription soient reconnus par l'hôte ce qui est improbable puisque justement les transgènes pris chez les bactéries voient ces signaux modifiés afin justement d'être reconnus chez l'hôte eucaryote.
+ les deux autres modes de transfert de l’information génétique pour les bactéries sont la transformation et la transduction. Pour ces transferts, Curtis assure un risque nul (" hautement improbable ")
Cependant, il existe plusieurs remises en question des calculs de Curtis. Le premier est tiré du livre " Les manipulations génétiques " d’Agata Mendel en 1981. Pour les auteurs de cet ouvrage, leurs trois probabilités sont différentes.
+ Par conjugaison : le risque de transfert d’un plasmide conjuguant peut atteindre 1 pour certains individus et à un certain moment donné. De plus, le risque de transfert d’un plasmide non-conjuguant peut être de 10-2. Enfin la probabilité d’une deuxième conjugaison est de 10-5 car après une fertilisation, la bactérie est hyperactive. Le risque total est donc de 1 x10-2 x10-5 = 10-7 soit une probabilité de 10-7 par bactérie et par jour. Or une suspension de culture bactérienne contient 10 puissance 8 bactéries par ml . Si une personne sensible (p=10-7 ) avale 0.1mL (10 puissance 7 bactéries) si 20% atteignent l’intestin et survivent, le transfert peut se produire.
+ Par transduction, Curtis dit que les phages traduisent mal les petits plasmides utilisés pour les manipulations génétiques. Or certains phages traduisent mieux les plasmides que le gène chromosomique et le phage le plus connu de l’Escherichia coli (P1) traduit bien certains plasmides de grandes tailles or certains plasmides se polymérisent et forment de grands plasmides.
La deuxième remise en cause provient d’une étude non publiée dirigée par Robert Havenaar. Selon cette étude les gènes de résistances aux antibiotiques peuvent séjourner dans le système digestif pendant 6 minutes. Or il y aurait 1 risque sur 10 millions que le transfert est lieu chez l’Enterococcus, une bactérie qui peuple l’intestin. Comme le tube digestif d’un homme est peuplé de milliards de bactéries, " le danger est loin d’être nul " dit le Néerlandais. D’après le Dc Arpad Pusztai, avec les méthodes d’insertion de gènes utilisées, le gène d’intérêt peut se retrouver n’importe où dans le génome de l’organisme cible. Il peut donc se recombiner avec les gènes entre lesquels il est inséré pour donner, éventuellement, une protéine imprévue mais comme déjà mentionné plus haut, il faut que beaucoup d'autres conditions soient réunies : intégration en phase de lecture, intégrité de la séquence, signaux de régulation/transcription reconnus, traduction effective et suffisante, fonctionnalité de la nouvelle protéine, durée de vie. Notons cependant que ce transfert potentiel peut se produire avec n'importe lequel des milliards de gènes que nous ingérons à chaque repas. Les transgènes n'ont aucune spécificité à être transféré plus que n'importe quel autre. Si donc un effet est donc totalement imprévisible, il reste dans tous les cas hautement improbable. On n'a d'ailleurs jamais fait de tests sur les produits commercialisés pour évaluer si ce risque existait où pas. Enfin, depuis 2005, l'utilisation de certains de ces gènes de résistances aux antibiotiques est interdite pour tous les nouveaux OGM à venir. Ceux qui restent correspondent à des résistances à des antibiotiques qui ne sont pas utilisés en médecine humaine. Enfin, il est utile de préciser que de 50 à 70% de nos bactéries (ainsi que celles du sol d'ailleurs) sont déjà résistantes aux antibiotiques.
Risque de toxicité éventuel
Un chercheur, Pusztai, a fait une expérience avec des rats et des pommes de terre. Celle-ci comprenait deux groupes de rats :
- L'un consommant des pommes de terre transgéniques (avec le gène codant une lectine).
- L'autre des pommes de terre ordinaires enrichies avec cette même protéine.
Les rats ayant mangé les pommes de terre transgéniques ont souffert d’un retard de développement de plusieurs organes vitaux tel le foie et le cerveau et une difficience du système immunitaire. Selon Pusztai, si ces défficiences étaient dues à la lectine, les deux groupes de rats auraient étés malades, or seul les rats nourris avec les OGM ont subi ces insuffisances. Ces travaux ont été largement critiqués par la communauté scientifique sur la base des protocoles expérimentaux utilisés (problèmes avec les témoins notamment) ainsi que sur le fait même d'avoir nourri les rats avec des pommes de terre crues (qu'ils ne mangent pas normalement). Enfin précisons que tout nouvel OGM avant de pouvoir être mis sur le marché subit de très nombreux tests visant à s'assurer de leur non toxicité (tests de toxicité aiguë, sub-chronique et d'alimentarité). Si les résultats de ces tests présentaient le moindre doute, l'OGM ne serait alors pas mis sur le marché.
Conséquences indirectes
1-D’une part certains OGM (comme le maïs Bt) produisent eux-même un insecticide donné et spécifique grâce au gène qui lui a été ajouté. Il faut néanmoins préciser que toute plante possède un nombre important de protéines qui sont des pesticides et donc dont certaines sont insecticides. La transgénèse ne fait que rajouter une protéine insecticide que la plante n'avait pas dans sa panoplie.
Il faut alors s'assurer de deux points :
- l'insecticide peut tuer une espèce donnée d'insecte ou en tout cas réduire une population d'insecte localement et donc déséquilibrer partiellement la partie de la chaîne alimentaire dans laquelle ces insectes interviendraient.
- que la protéine toxique pour l'insecte ne le soit pas également pour l'homme ou les animaux.
Ce type de test est requis avant de mettre sur le marché ce type d'OGM.
2-Dans certaines plantes, on introduit un gène de tolérance à un herbicide donné pour pouvoir le pulvériser à différents stades de croissance de la plante (mais en général, aux stades pré-levée puis post-levée, donc très tôt au cours du développement de la plante).
Le gène introduit code une enzyme modifiée par rapport à celle que la plante possède déjà. Alors que cette dernière est inhibée dans son fonctionnement par l'action de l'herbicide et comme elle intervient dans un métabolisme essentiel à la vie de la plante, cette dernière en meurt. Par contre, l'enzyme modifiée y est insensible et peut donc continuer à fonctionner normalement. Dans certains OGM, il y a, parfois, un autre gène qui code une enzyme capable de dégrader le glyphosate en un autre métabolite l' AMPA.
Des questions complémentaires peuvent alors se poser :
-Ces métabolites sont-ils toxiques ?
-Sont-ils allergènes pour les hommes ?
Ces aspects sont traités par la commission des toxiques et d'homologation de n'importe quel pesticide. Rappelons que l'utilisation des herbicides n'est pas limitée aux seuls OGM. Ils sont utilisés depuis longtemps sur les plantes obtenues de manière conventionnelle. Les OGM nécessitent en général deux passages alors qu'il en faut en moyenne 4 pour les plantes conventionnelles.
3- la dissémination du pollen des plantes transgéniques se fait tout comme celle des plantes non transgéniques. Grâce aux techniques de biologie moléculaire, il a été possible de mesurer cette dissémination, ce qui était quasiment impossible antérieurement.
Ainsi, des chercheurs de l'INRA ont étudié la pollinisation croisée du colza GM vers la ravenelle (cousine sauvage du colza dont la période de fécondité est identique à celle du colza). Si celle ci est effectivement possible, cette dissémination reste faible (1 à 2%) mais surtout, il a été montré que les gènes venant du colza vers la ravenelle disparaissait au bout de 4 générations, montrant ainsi qu'il y a une réversibilité possible dès lors qu'il n'y a pas de pression de sélection particulière. Le risque serait que la ravenelle acquière la résistance à l’herbicide et ne puisse plus être détruite par cet herbicide mais dans cette étude, aucune plante de ravenelle tolérante à l’herbicide n’a été trouvée. Mais au Danemark, une étude de chercheurs a montré qu’en deux générations, le transgène de tolérance au Basta s’intègre au génome de la ravette, (autre cousine du colza). Ces navettes modifiées n'ont pas de phénotypes particulier qui permettraient de les distinguer de la variété sauvage. Cette pollinisation croisée a été montrée également chez la betterave à sucre et la luzerne. Une étude française a montré que le risque de dissémination d’une population entière devenait important à partir d’un certain nombre d’individus pollinisés.
4-Un autre aspect se situe dans le cadre de l'évolution des espèces. Dans le cas du maïs Bt, ce maïs sécrète une protéine qui par action indirecte provoque la mort des larves de pyrales. Comme tous les êtres vivants évoluent, il y a donc une probabilité non nulle pour que certaines pyrales deviennent insensibles à cette toxine. Ce point est d'ailleurs une constante de l'amélioration des plantes, c'est la raison pour laquelle, il est nécessaire de créér de nouvelles variétés en permanence afin de les rendre résistantes à leurs prédateurs qui évoluent en permanence.
Au sein d'une unité de recherche biologique de l’INRA, les chercheurs n’ont pas obtenu de Pyrales résistantes au bout de vingt-six générations. Mais pour Pierre Gouyon, spécialiste de la biologie des populations, " ces chercheurs n’ont absolument pas la notion des grandeurs en écologie ". En effet, aux Etats-Unis, des souches de Pyrales résistantes au Bt ont été découvertes. Néanmoins et après dix ans de cultures à grande échelle de ces OGM Bt, aucune n'a vu encore cette résistance contournée. Mais encore une fois, ce serait normal si cela venait à se produire.
Par rapport aux résistances aux insectes que l'on a pu conférer dans le passé à certaines plantes (par sélection conventionnelle), on peut dire, pour l'instant, que le contournement met plus de temps à se produire avec cette stratégie Bt.
Notes et références
- ↑ (fr)Pour une gestion éthique des OGM, Commission de l’éthique de la science et de la technologie du Québec, avis adopté à la 10e réunion de la Commission de l’éthique de la science et de la technologie le 16 octobre 2003 (ISBN 2-550-41769-6), 4e trimestre 2003 [lire en ligne]
- ↑ Selon la directive communautaire 2001/18/CE, relative à la dissémination volontaire d'organismes génétiquement modifiés dans l'environnement, la définition règlementaire d'un OGM pour l'Union européenne
- ↑ Argentine : Les promesses non-tenues des semences transgéniques sur le site tsr.ch
- ↑ (Kleter GA, Peijnenburg AA (2003), Presence of potential allergy-related linear epitopes in novel proteins from conventional crops and the implication for the assessment of these crops with respect to the current testing of geneticlaly modified crops. Plant Biotechnology Journal 2003 Spet 1(5):371-380)